题目内容
1.制备多晶硅(硅单质的一种)的副产物以SiCI4为主,其对环境污染很大,遇水强烈水解,放出大量热量.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2•2H2O,工艺流程如图:
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
(1)①SiCl4水解控制在40℃以下的原因是防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈.
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=189kJ/mol
则SiCl4被H2还原制备硅的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol.
(2)加钡矿粉时生成BaCl2的离子反应方程式是BaCO3+2H+=Ba2++CO2+H2O↑.
(3)过滤②的滤渣A的化学方程式为Fe(OH)3,接着往滤渣中加20%NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式为Mg(OH)2,控制温度70℃的目的是确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小).
(4)滤液③经蒸发浓缩、冷却结晶、过滤等操作,再经真空干燥后得到BaCl2•2H2O.
分析 根据流程图可知SiCl4水解生成的盐酸和原硅酸,过滤得到盐酸,盐酸与钡矿粉反应,主要生成BaCl2,同时溶液中含有钙、铁、镁等离子,通过调节PH值一一除去,最终得到BaCl2•2H2O.
(1)氯化硅水解生成原硅酸和氯化氢;温度越高,氯化硅的水解速率越大,氯化氢的挥发越强;将两个方程式相加即得则由SiCl4制备硅的热化学方程式,注意焓变进行相应的改变;
(2)加钡矿粉时生成BaCl2是碳酸钡溶解于酸中反应生成;
(3)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值确定滤渣的成分;根据氢氧化钙溶解度随温度升高减小;
(4)根据从溶液中析出固体的方法分析解答.
解答 解:(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl,温度高时,氯化硅的水解速率增大,氯化氢的挥发增强,且氯化氢能污染环境,温度较低时,能防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈,
由盖斯定律可知:将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(2)碳酸钡和盐酸反应生成氯化钡,反应的方程式为:BaCO3+2H+=Ba2++CO2+H2O↑;
故答案为:BaCO3+2H+=Ba2++CO2+H2O↑;
(3)当pH=3.4时,铁离子完全生成沉淀,所以当pH=7时,滤渣A的成分是氢氧化铁;当pH=12.4时,镁离子完全沉淀生成Mg(OH)2,所以当pH=12.5时,滤渣B的成分是氢氧化镁;控制温度70℃的目的是确保钙离子完全除去;
故答案为:Fe(OH)3;Mg(OH)2;确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小);
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤;
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查了物质制备流程分析判断,物质性质的应用,盐类水解、沉淀形成条件,杂质除去方法,试剂选择,离子方程式书写,盖斯定律应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与 醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B | 苯酚钠溶液中 通入CO2 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| C | NaHCO3的水解 | HCO3-+H2O=CO32-+H3O+ | 错误,水解方程式 误写成电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
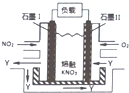 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
| A. | 18gH218O含有l0NA个质子 | |
| B. | 过量铁粉在氯气中燃烧生成FeCl2 | |
| C. | 0.1mol•L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+ | |
| D. | 在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS) |
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
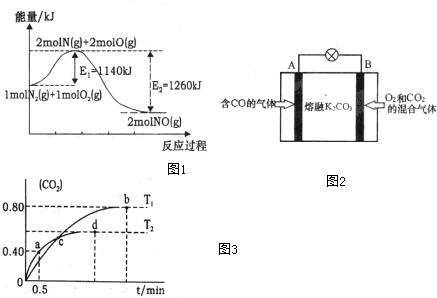
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
| A. | H2SO4(稀)$→_{△}^{Cu}$SO2$\stackrel{少量氨水}{→}$NH4HSO3$\stackrel{足量氨水}{→}$(NH4)2SO3 | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | Al$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{足量盐酸}{→}$AlCl3溶液$\stackrel{△}{→}$无水AlCl3 |

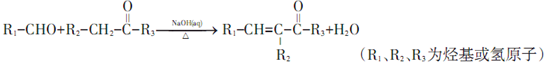
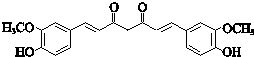 ;
;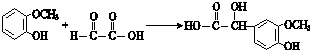 ;其反应类型是加成反应;
;其反应类型是加成反应;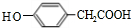 (写结构简式).
(写结构简式).