题目内容
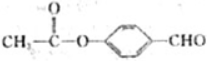
15.下列关于普伐他汀的水解产物(结构简式如图)的说法正确的是( )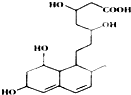
| A. | 含有两种官能团 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
分析 分子中含有-OH,可发生取代、消去和氧化反应,含有-COO-,可发生水解反应,含有-COOH,具有酸性可发生中和、取代反应,含有C=C,可发生加成、加聚和氧化反应,注意不含苯环.
解答 解:A.分子中含有碳碳双键、-OH、-COOC-、-COOH等四种官能团,故A错误;
B.分子中含有碳碳双键,可发生加成、氧化反应,含有羟基、羧基,可发生酯化反应,故B正确;
C.分子中含有4个羟基,1个羧基,1mol该物质与足量Na反应,产生2.5molH2,共5g,故C错误;
D.可与溴水发生加成反应,与酸性高锰酸钾发生氧化还原反应,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇及酯性质的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 航天服材质是由碳化硅、陶瓷和碳纤维等复合而成,它是一种新型有机合成材料 | |
| B. | 煤中含有苯、二甲苯等,可以通过煤的干馏得到,并将它们分离 | |
| C. | 经过一定的化学变化,可以从海水中提取氯化钠、镁、溴等 | |
| D. | 在海轮外壳镶嵌锌块,能减缓轮船的腐蚀,是利用牺牲阳极的阴极保护法 |
6.当前我国环境状况不荣乐观,其中PM2.5、CO、SO2、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义,请回答下列问题:
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算该试样的pH=4.
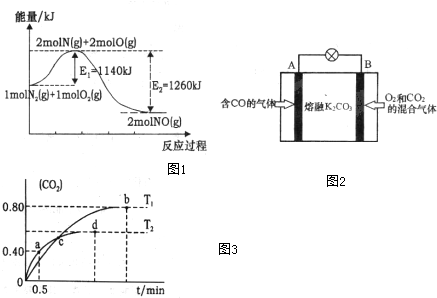
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
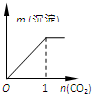
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)

7.空气的成分中,体积分数约占 78%的是( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 稀有气体 |
5. 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
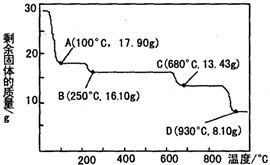
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
①(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
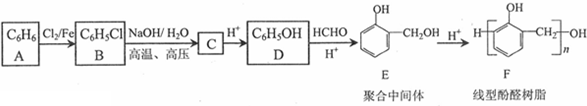
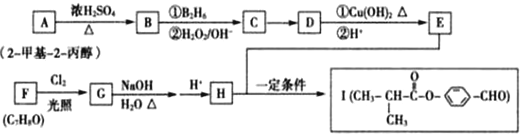
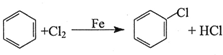 ,反应类型为取代反应
,反应类型为取代反应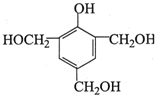
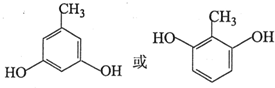 (写出其中一种的结构简式);
(写出其中一种的结构简式);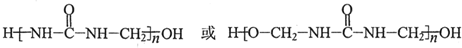 .
.



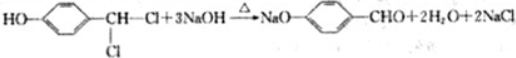 .
.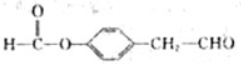 、
、 .
.