题目内容
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )
| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
分析 A、根据反应中反应物减少,生成物增加,物质的量变化量之比等于计量数之比判断化学方程式;
B、反应达到平衡状态时正逆反应速率相等,各组分的物质的量不变,据此判断;
C、其他条件不变,缩小容器的体积,压强增大,根据压强对反应速率的影响判断;
D、根据v=$\frac{\frac{△n}{V}}{△t}$计算N的平均反应速率;
解答 解:A、根据图中知,反应中N减少,M增加,M、N物质的量变化量之比为1:2,所以该反应的化学方程式为2N?M,故A错误;
B、根据图中知,t2时各组分的物质的量还在变化,所以正逆反应速率不相等,故B错误;
C、其他条件不变,缩小容器的体积,压强增大,反应速率加快,故C正确;
D、根据v=$\frac{\frac{△n}{V}}{△t}$可知,N的平均反应速率为$\frac{\frac{2mol}{2L}}{{t}_{1}}$mol/(L•min),故D错误;
故选C.
点评 本题考查化学平衡的变化图象,题目难度不大,本题注意化学方程式的确定方法,平衡状态的判断以及反应速率和转化率的计算,把握好相关概念和公式的理解及运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
19.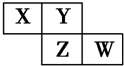 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Z、W的气态氢化物还原性:W>Z | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
6.下列化学用语使用正确的是( )
| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
16. 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )| A. | 阴影部分面积表示H2物质的量浓度的减少 | |
| B. | 反应达到限度时,H2、I2、HI的物质的量浓度比一定为1:1:2 | |
| C. | 当容器中密度保持不变时,说明反应一定达到平衡状态 | |
| D. | 若0~10s内,HI的平均速率为0.01mol/(L•s),10s时H2余1.9mol,则容器体积V为2L |
3.下列叙述不正确的是( )
| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
1.下列说法中正确的是( )
| A. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | S、C、Si都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应 | |
| D. | 碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物 |