题目内容
3.下列叙述不正确的是( )| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
分析 A.化学是一门研究物质的组成、结构、性质以及物质变化规律的科学;
B.有机物的反应一般不在水溶液中进行;
C.根据反应原理,可以合成新物质;
D.高分子化合物与低分子有机物结构不同,性质不同.
解答 解:A.有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学,故A正确;
B.有机物的反应一般不在水溶液中进行,无机物的反应常在水溶液中进行,故B错误;
C.根据反应原理,可以合成合成具有特定性质的、自然界并不存在的有机物,以满足人类的特殊需要,故C正确;
D.高分子化合物与低分子有机物结构不同,物理性质、化学性质不同,故D正确.
故选B.
点评 本题考查有机反应的特点,难度不大,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.下表中的数据是破坏或生成1mol物质中的化学键所消耗或吸收的能量(单位:kJ):
根据上述数据回答:
(1)下列氢化物中最稳定的是A(填序号).
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
根据上述数据回答:
| 物质 | Cl2 | Rr2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
14.下列性质的递变中,正确的是( )
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )


| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
18.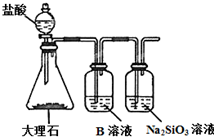 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
(1)上述元素的原子中,得电子能力最强的是氟(填元素名称).
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
8.以溴乙烷为主要原料制乙二酸时,经过的最佳途径反应顺序为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧 | D. | 取代-加成-氧化-消去 |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,0.1 mol•L-1醋酸钠溶液中含有Na+和CH3COO-的总数为0.2NA | |
| B. | 常温下,将0.1 mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA | |
| C. | 2 g NO2和44 g N2O4的混合气体中所含原子的总数为3NA | |
| D. | 0.1 mol甘油醛中含有双键的数目为0.3NA |
13.X、Y、Z、W、M五种元素的原子序数依次增大.已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.M是地壳中含量最高的金属元素.下列说法正确的是( )
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |