题目内容
1.一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成.某校化学研究性学习小组对此进行研究.按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加.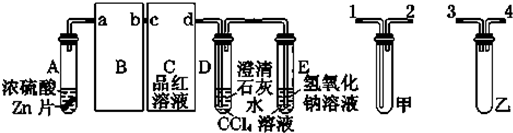
试回答:
(1)装置A中需用浓H2SO4,用两种简单的方法确定一瓶H2SO4一定是浓H2SO4:用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4).
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接3(或4)、4(或3)接b,c接2、1接d;D、E两支试管中CCl4溶液的作用是防止倒吸.
(3)能证明浓硫酸具有强氧化性的实验现象为C中品红溶液褪色;
反应较长时间后气泡量又会明显增加的原因是浓H2SO4变成稀H2SO4,与Zn反应放出H2.
(4)D中浑浊消失的离子方程式为SO2+CaSO3+H2O=Ca2++2HSO3-.
分析 (1)根据浓硫酸具有脱水性或溶于水放热角度解答;
(2)B的作用是防止倒吸;C装置的作用是检验二氧化硫的漂白性,可用洗气装置; 乙可防止倒吸;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性;随反应进行浓H2SO4变成稀H2SO4;
(4)过量的二氧化硫能使亚硫酸钙溶解,所以浑浊会消失.
解答 解:(1)浓硫酸具有脱水性,浓硫酸溶于水会放热大量热,所以鉴别方法有:用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4,
故答案为:用火柴梗蘸取少量试液,火柴梗若立即变黑,证明是浓H2SO4(或用滴管吸取少量试液,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4);
(2)B的作用是防止倒吸,可将乙填入B中;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,DE中的四氯化碳可以防止气体吸收时倒吸,
故答案为:3(或4);4(或3); 2; 1;防止倒吸;
(3)有二氧化硫生成能证明浓硫酸具有强氧化性,二氧化硫能使品红褪色,随着反应的进行,浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2,
故答案为:C中品红溶液褪色;浓H2SO4变成稀H2SO4,与Zn反应放出H2;
(4)过量的二氧化硫能使亚硫酸钙溶解,反应的离子方程式为:SO2+CaSO3+H2O=Ca2++2HSO3-,
故答案为:SO2+CaSO3+H2O=Ca2++2HSO3-.
点评 本题考查了浓硫酸的性质,题目难度中等,明确实验原理及化学实验基本操作方法为解答关键,注意掌握浓硫酸、二氧化硫的性质及检验方法,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
17.下列离子方程式与所述事实相符且正确的是( )
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
6.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
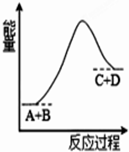

| A. | 该反应为释放能量 | |
| B. | 该反应为吸收能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
13.下表中的数据是破坏或生成1mol物质中的化学键所消耗或吸收的能量(单位:kJ):
根据上述数据回答:
(1)下列氢化物中最稳定的是A(填序号).
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
根据上述数据回答:
| 物质 | Cl2 | Rr2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
10.下列反应的产物一定是纯净物的是( )
| A. | 丙烯加聚 | B. | 丙烯与水加成 | C. | 丙烯与Br2加成 | D. | 丙烷与Br2光取代 |
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )


| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |