题目内容
19.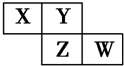 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Z、W的气态氢化物还原性:W>Z | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
分析 X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X、Y为第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,根据其位置知X是N元素、Z是S元素、W是Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其氢化物的还原性越弱;
D.四种元素对应的单质中,常温下S为固体,而其它3种都是气体.
解答 解:X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X、Y为第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,根据其位置知X是N元素、Z是S元素、W是Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Z>W>X>Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性W>Z,所以其最高价氧化物的水化物酸性W>Z,故B错误;
C.元素的非金属性越强,其氢化物的还原性越弱,非金属性W>Z,所以Z、W的气态氢化物还原性:W<Z,故C错误;
D.四种元素对应的单质中,常温下S为固体,而其它3种都是气体,所以Z(S元素)对应的单质沸点最高,故D正确;
故选D.
点评 本题考查了元素周期表和元素周期律综合应用,灵活运用元素周期律知识解答即可,知道同一周期、同一主族元素性质变化规律,题目难度不大.

练习册系列答案
相关题目
10.下列反应的产物一定是纯净物的是( )
| A. | 丙烯加聚 | B. | 丙烯与水加成 | C. | 丙烯与Br2加成 | D. | 丙烷与Br2光取代 |
14.下列性质的递变中,正确的是( )
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
4.选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 溴苯?(溴) |
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )


| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
8.以溴乙烷为主要原料制乙二酸时,经过的最佳途径反应顺序为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧 | D. | 取代-加成-氧化-消去 |
9.有下列五种物质:①2-甲基丁烷;②2,2-二甲基丙烷;③戊烷;④丙烷;⑤丁烷.它们的沸点由高到低的顺序正确的是( )
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ④⑤②①③ | D. | ③①②⑤④ |
 .
.