题目内容
6.下列化学用语使用正确的是( )| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
分析 A.重氢原子含有1个中子,质量数为1+1=2,原子符号为12H或D;
B.镁离子的核电荷数为12,不是10;
C.氨气的电子式中漏掉了氮原子的一对孤电子对;
D.次氯酸钙为弱电解质,在溶液中完全电离出钙离子和次氯酸根离子.
解答 解:A.重氢原子含有1个中子,质量数为:1+1=2,重氢正确的原子符号为12H,故A错误;
B.Mg2+的质子数为12,电子数为10,正确的离子结构示意图为: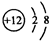 ,故B错误;
,故B错误;
C.氨气有3个氢原子和1个氮原子分别共用1对电子形成,正确的电子式为: ,故C错误;
,故C错误;
D.Ca(ClO)2在溶液中完全电离出钙离子和次氯酸根离子,其电离方程式为:Ca(ClO)2=Ca2++2ClO-,故D正确;
故选D.
点评 题考查了电子式、离子结构示意图、电离方程式、元素符号的书写,题目难度中等,充分考查了学生对所学知识的掌握情况,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列性质的递变中,正确的是( )
| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )


| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
18.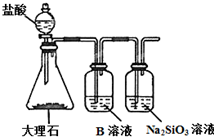 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
(1)上述元素的原子中,得电子能力最强的是氟(填元素名称).
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
 如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.
如表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空.| 族 周期 | ⅠA | 0 | ||||||||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
| 2 | X | Y | G | |||||||||||
| 3 | Z | … | H | W | E | |||||||||
| 4 | … | Q | ||||||||||||
(2)E元素与Q元素两者核电荷数之差是18.
(3)G对应离子的半径>Z对应离子的半径(填“<”或“>”).
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+2H2↑.
(5)为比较元素X和W的非金属性强弱,用如图所示装置进行实验(夹持仪器已略去,装置气密性良好).溶液B的作用是除去CO2中的HCl,能说明X和W非金属性强弱的离子方程式是CO2+SiO32-+H2O═CO32-+H2SiO3↓.
16.常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 向0.1mol•L-1pH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
 (1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3.
(1)AlN的晶体结构与单晶硅相似,在AlN晶体中,每个Al原子与4个N原子相连,与N元素同主族的元素As位于元素周期表的第四周期,其基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3. 如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.
如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.