题目内容
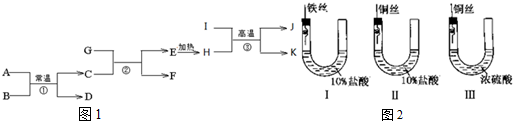
16. 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )| A. | 阴影部分面积表示H2物质的量浓度的减少 | |
| B. | 反应达到限度时,H2、I2、HI的物质的量浓度比一定为1:1:2 | |
| C. | 当容器中密度保持不变时,说明反应一定达到平衡状态 | |
| D. | 若0~10s内,HI的平均速率为0.01mol/(L•s),10s时H2余1.9mol,则容器体积V为2L |
分析 A、在反应中氢气的物质的量的变化量是正逆反应速率之差与时间的乘积,据此判断;
B、反应达到限度时,H2、I2、HI的物质的量浓度与起始加入的量有关,同时也与反应进行的程度有关;
C、该反应气体质量守恒,反应在恒容条件下进行,所以反应前后气体的密度始终不变;
D、根据v=$\frac{\frac{△n}{V}}{△t}$可计算容器的体积.
解答 解:A、在反应中氢气的物质的量的变化量是正逆反应速率之差与时间的乘积,而图中阴影部分正是表达这部分内容,故A正确;
B、反应达到限度时,H2、I2、HI的物质的量浓度与起始加入的量有关,同时也与反应进行的程度有关,所以平衡时I2与HI不一定是1:2,故B错误;
C、该反应气体质量守恒,反应在恒容条件下进行,所以反应前后气体的密度始终不变,所以密度不能作为该反应平衡状态的判断标志,故C错误;
D、根据v=$\frac{\frac{△n}{V}}{△t}$可知,容器的体积=$\frac{2mol-1.9mol}{0.01mol/(L•s)×10s}$=1L,故D错误.
故选:A.
点评 本题考查了可逆反应的图象、化学平衡状态的分析与判断、反应速率的应用,掌握原理应用是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
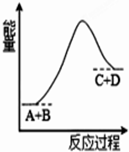

| A. | 该反应为释放能量 | |
| B. | 该反应为吸收能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
4.选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
| 序号 | 物质 | 试剂 | 除杂方法 |
| ① | 甲烷(C2H4) | ||
| ② | 溴苯?(溴) |
11.在一定温度下,体积为2L的容器内M、N的物质的量随时间变化的曲线如图所示,下列说法正确( )


| A. | 反应方程式为N?2M | |
| B. | t2时,正逆反应速率相等 | |
| C. | 其他条件不变,缩小容器的体积,反应速率会加快 | |
| D. | 若t1=1,则0~t1时间段N的平均速率为3mol/(L•min) |
8.以溴乙烷为主要原料制乙二酸时,经过的最佳途径反应顺序为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧 | D. | 取代-加成-氧化-消去 |
5.已知:C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/mol
C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
H2O(g)═H2O(l)△H3=-c kJ/mol
若使92g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
H2O(g)═H2O(l)△H3=-c kJ/mol
若使92g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A. | 4a+4b+4c | B. | 2a-2b+6c | C. | 2a-2b+2c | D. | 2a-6b+2c |
6.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol CH5+所含电子数为8nA | |
| B. | 标准状况下,11.2L Br2中Br原子数为nA | |
| C. | 1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA | |
| D. | 18g的D216O中含有的中子数为9 NA |
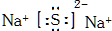 .
. ,F的电子式为
,F的电子式为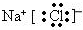 .
.