题目内容
15.将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
分析 混合溶液中溶质为等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答 解:混合溶液中溶质为等物质的量浓度的NaCl、CH3COOH、CH3COONa,混合溶液呈酸性,说明醋酸的电离程度大于醋酸根离子水解程度,
A.反应后溶液是NaCl、CH3COOH、CH3COONa的物质的量相等的混合溶液,溶液显酸性,说明HAc电离程度大于Ac-水解程度,则(Ac-)>c (Cl-),故A错误;
B.根据物料守恒得c (Ac-)+c (HAc)=$\frac{0.2×V}{2V}$=0.1mol/L,故B正确;
C.反应后溶液是NaCl、CH3COOH、CH3COONa的物质的量相等的混合溶液,醋酸的电离程度和醋酸根离子的水解程度都很小,所以(Ac-)>c (H+),故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,知道弱电解质电离特点,题目难度不大.

练习册系列答案
相关题目
5.下列溶液加热蒸干灼烧后,能得到该溶质固体的是( )
| A. | Al2(SO4)3 | B. | NaHCO3 | C. | Fe(NO3)3 | D. | NH4Cl |
3.50mL BaCl2溶液和20mL0.5mol/L的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
10.化学与生活、社会、材料密切相关.下列说法不正确的是( )
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
20.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
7.浓度均为0.1mol/L的五种溶液:①CH3COOH ②Ba(OH)2 ③CH3COONa ④NaOH ⑤Na2CO3中,由水电离出的c(H+)按由小到大的排列正确的是( )
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
4.将洁净的金属片放置在浸有某种溶液的滤纸上面并压紧(如图所示).下列有关说法正确的是( )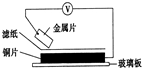

| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
5.下列离子方程式正确的是( )
| A. | FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 苯酚钠溶液中通入少量CO2: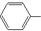 O-+CO2+H2O→ O-+CO2+H2O→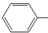 OH+HCO3- OH+HCO3- | |
| C. | NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++2HCO3-+2OH-═CaCO3↓+H2O+CO32- | |
| D. | BaCO3固体中加入足量稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.