题目内容
3.50mL BaCl2溶液和20mL0.5mol/L的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
分析 根据氯离子和银离子的恰好完全反应Ag++Cl-═AgCl↓,求出Cl-的物质的量浓度.
解答 解:由于氯离子和银离子恰好完全反应,Ag++Cl-═AgCl↓,则银离子的物质的量和硝酸银的物质的量相等,
所以设BaCl2溶液中氯离子的物质的量浓度为x.
Ag++Cl-═AgCl↓
1mol 1mol
20×10-3L×0.5mol/L 50×10-3L×x
解得:x=0.2mol/L,
故选B.
点评 本题考查化学方程式计算、物质的量浓度计算,侧重对基础知识的巩固,题目难度不大.

练习册系列答案
相关题目
13.有关下列装置或操作的说法正确的是( )
| A. | 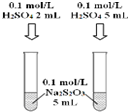 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 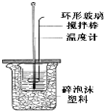 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 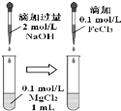 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 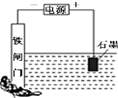 中金属防护方法叫做牺牲阳极的阴极保护法 |
14.下列实验操作中,能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
11.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
| A. | 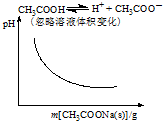 | B. | 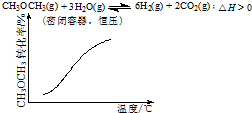 | ||
| C. |  | D. | 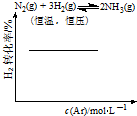 |
18.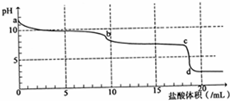 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
8.实验室制取氯气并回收氯化锰,能达到该实验目的装置是( )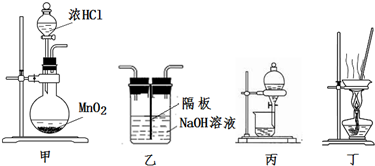

| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
15.将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
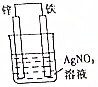 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.