题目内容
10.化学与生活、社会、材料密切相关.下列说法不正确的是( )| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
分析 A.依据制备玻璃工业的步骤和反应原理分析,利用纯碱溶液水解显碱性使油脂水解;
B.盐卤点豆腐、明矾净水涉及到胶体的聚沉等性质;
C.加热能够使蛋白质变性;
D.光导纤维主要成分是二氧化硅.
解答 解:A.纯碱可用于生产普通玻璃,碳酸钠和二氧化硅反应生成硅酸钙和二氧化碳,可用纯碱除去物品表面的油污,油脂在碱溶液中水解生成溶于水的物质,故A正确;
B.盐卤点豆腐,利用了胶体的聚沉的性质,明矾水解可生成具有吸附性的氢氧化铝胶体,故B正确;
C.细菌病毒是蛋白质,加热能够使蛋白质失去生理活性,可杀死病毒,故C正确;
D.光导纤维主要成分是二氧化硅,是无机非金属材料,不是高分子材料,故D错误;
故选:D.
点评 本题考查了物质的性质及用途,熟悉碳酸钠的性质、胶体的性质、蛋白质的性质、光导纤维的成分即可解答,题目难度不大,注意蛋白质的变性为不可逆过程.

练习册系列答案
相关题目
1.由环已烷、乙醇、乙醚(C4H10O)组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数为( )
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
18.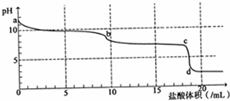 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
15.将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
2. 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
20.化学与社会息息相关,下列物质在社会、生活中的应用及解释都正确的是( )
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
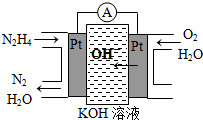 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题

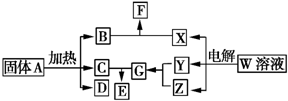 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.