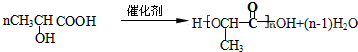
题目内容
20.下列有关电解质溶液的说法正确的是( )| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A.KW只受温度的影响,注意氢氧化钠溶于水放热;
B.0.1mol/LHF溶液的pH=2,则c(H+)=0.01mol/L,常温下,c(OH-)=1×10-12mol/L;
C.根据质子守恒判断;
D.CH3COONH4发生互促水解,促进水的电离.
解答 解:A.KW只受温度的影响,因NaOH溶于水放热,则温度升高,水的离子积常数增大,故A错误;
B.0.1mol/LHF溶液的pH=2,则c(H+)=0.01mol/L,常温下,c(OH-)=1×10-12mol/L,c(F-)略小于0.01mol/L,c(HF)略大于0.09mol/L,则c(OH-)<c(HF),故B错误;
C.在Na2S稀溶液中,根据质子守恒可得:c(OH-)=c(H+)+2c(H2S)+c(HS),即c(H+)=c(OH-)-2c(H2S)-c(HS-),故C正确;
D.CH3COONH4发生互促水解,促进水的电离,水的电离程度增大,故D错误.
故选C.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
11.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
| A. | 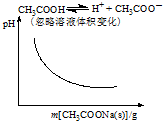 | B. | 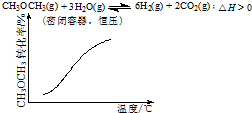 | ||
| C. |  | D. | 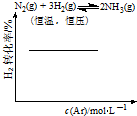 |
8.实验室制取氯气并回收氯化锰,能达到该实验目的装置是( )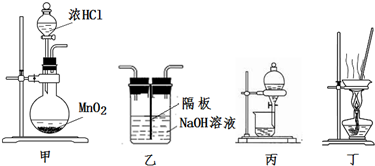

| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
15.将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
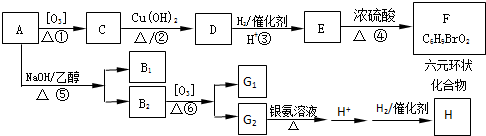
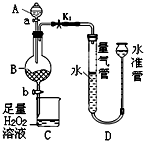 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
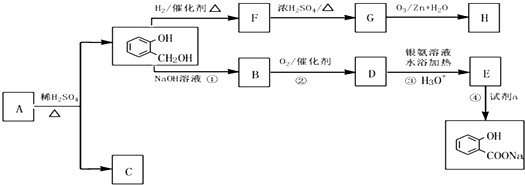
 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验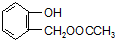 ,由F到G的反应类型为消去反应.
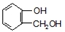
,由F到G的反应类型为消去反应.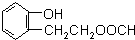 和
和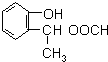 (不考虑立体异构).
(不考虑立体异构). .
.
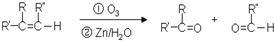
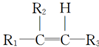 $\stackrel{[O_{3}]}{→}$
$\stackrel{[O_{3}]}{→}$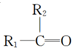 +
+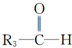
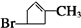

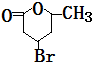 +H2O
+H2O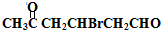 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$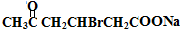 +Cu2O↓+3H2O
+Cu2O↓+3H2O