题目内容
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )
| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
分析 2min时,△c(A)=(18-9)mol/L=9mol/L,△c(B)=(18-0)mol/L=18mol/L,反应时间为2min,根据v=$\frac{△c}{△t}$计算反应速率,据此分析解答.
解答 解:2min时,△c(A)=(18-9)mol/L=9mol/L,△c(B)=(18-0)mol/L=18mol/L,反应时间为2min,
v(A)=$\frac{9}{2}$ mol/(L•min)=4.5mol/(L•min),
v(B)=$\frac{18}{2}$mol/(L•min)=9mol/(L•min),且v(A):v(B)=4.5mol/(L•min):9mol/(L•min)=1:2,故选C.
点评 本题考查化学反应速率定量表示方法,为基础题,明确反应速率公式中各个物理量的关系即可解答,知道反应速率与计量数的关系,题目难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
18. 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量 B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量 D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.
 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量 B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量 D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ.
16.Mg3N2与水反应的化学方程式为Mg3N2+6H2O═3Mg(OH)2+2NH3↑,下列说法错误的是( )
| A. | 上述反应中,有两种离子化合物 | |
| B. | Mg3N2中,N3-的半径比Mg2+的半径大 | |
| C. | H2O与NH3含有相同的电子数,但H2O比NH3的稳定性差 | |
| D. | 碱性:Mg(OH)2>Al(OH)3 |
3.在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为2mol•L-1、1mol•L-1、2mol•L-1.当反应达到平衡时,容器内各物质的浓度可能为( )
| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |
17.下表为周期表的一部分,有关短周期X、Y、Z、R四种元素叙述正确的是( )
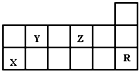

| A. | 热稳定性:Y的气态氢化物<Z的气态氢化物 | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R元素的单质化学性质活泼 |
18.下列过程能实现热能转化为化学能的是( )
| A. | HCl十NaOH=NaCl十H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO十H2O=Ca(OH)2 |