题目内容
19.X、Y两种元素能形成XY2型化合物,1molXY2含有38mol电子.若XY2为共价化合物,则其化学式为CS2或BeC12,结构式为S=C=S、Cl-Be-Cl,共价键的极性为极性共价键,键角为180°.分析 由化学式XY2可大致判定两元素为IIA、VIIA族元素或IVA或VIA族元素;具体为:BeCl2、CaF2、CS2,离子化合物为CaF2,共价化合物为CS2或BeC12,以此解答该题.
解答 解:由化学式XY2可大致判定两元素为IIA、VIIA族元素或IVA或VIA族元素;具体为:BeCl2、CaF2、CS2,共价化合物为CS2或BeC12,CS2或BeC12的结构式分别为S=C=S、Cl-Be-Cl,为直线形分子,键角为180°,都为极性共价键,
故答案为:CS2或BeC12;S=C=S、Cl-Be-Cl;极性共价键;180°.
点评 本题综合考查元素的位置、结构和性质以及共价键知识,为高频考点,主要把握常见元素的化合价以及结构特点,难度不大.

练习册系列答案
相关题目
10.下列反应中属于吸热反应的是( )
| A. | 甲烷燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 氧化钙与水反应 |
14.下列各组元素的原子序数中,其相应的元素原子能形成XY2型共价化合物的是( )
| A. | 3与8 | B. | 6与8 | C. | 1与16 | D. | 12与17 |
4.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 聚乙烯、聚乙炔都不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其中一溴取代物只有一种 |
11.下列化学用语所表示的微粒中,不能与盐酸发生化学反应的是( )
| A. |  | B. | ${\;}_{11}^{23}$Na | C. | 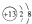 | D. | Mg |
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
9.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 加热氯酸钾使其分解 | ||
| C. | 干冰升华 | D. | 二氧化硅熔化 |
 氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题:
氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题: 的沸点比
的沸点比 高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.
高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.