题目内容
16.Mg3N2与水反应的化学方程式为Mg3N2+6H2O═3Mg(OH)2+2NH3↑,下列说法错误的是( )| A. | 上述反应中,有两种离子化合物 | |
| B. | Mg3N2中,N3-的半径比Mg2+的半径大 | |
| C. | H2O与NH3含有相同的电子数,但H2O比NH3的稳定性差 | |
| D. | 碱性:Mg(OH)2>Al(OH)3 |
分析 A、Mg3N2、Mg(OH)2是离子化合物;
B、电子层结构相同,核电荷数越大半径越小;
C、H2O与NH3含有相同的电子数都是10个,氧的非金属性强,所以H2O比NH3的稳定性强;
D、金属性越强最高价氧化物对应水化物的碱性越强.
解答 解:A、Mg3N2、Mg(OH)2是离子化合物,所以有两种离子化合物,故A正确;
B、电子层结构相同,核电荷数越大半径越小,所以N3-的半径比Mg2+的半径大,故B正确;
C、H2O与NH3含有相同的电子数都是10个,氧的非金属性强,所以H2O比NH3的稳定性强,故C错误;
D、金属性越强最高价氧化物对应水化物的碱性越强,金属性Mg>Al,所以碱性:Mg(OH)2>Al(OH)3,故D正确;
故选C.
点评 本题考查第三周期元素的性质及变化规律为解答的关键,侧重分析与应用能力的考查,注意熔点比较、离子半径比较为解答的难点,题目难度不大.

练习册系列答案
相关题目
4.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 聚乙烯、聚乙炔都不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其中一溴取代物只有一种 |
11.下列化学用语所表示的微粒中,不能与盐酸发生化学反应的是( )
| A. |  | B. | Na | C. | 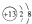 | D. | Mg |
1. 某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )
某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )
 某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )
某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )| A. | Q点消耗CH3COOH溶液的体积等于NaOH溶液的体积 | |
| B. | M、Q、N三点都满足:C(Na+)+C(H+)═c(CH3COO-)+C(OH-) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(CH3COO-)<c(Na+) |
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
5.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
6.已知:H2(g)+F2(g)═2HF(g);△H=-270kJ/mol,下列说法正确的是( )
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 该反应中的能量变化可用如图来表示 |
 氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题:
氧(O)、硫(S)、硒(Se)、碲(Te)为ⅥA族元素,请回答下列问题: 的沸点比
的沸点比 高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.
高,原因是对羟基苯甲醛分子间能形成氢键、邻羟基苯甲醛分子内能形成氢键.