题目内容
20.向30℃饱和硫酸铜溶液中加入10g无水硫酸铜,可析出晶体的质量为18.18g,若将上述溶液250g蒸发掉50g水降至10℃,可析出晶体的质量为41.40g(CuSO4的溶解度:30℃时25g,10℃时17.4g)分析 向30℃饱和硫酸铜溶液中加入10g无水硫酸铜,析出五水硫酸铜晶体,原饱和硫酸铜溶液中的水减少,也会析出晶体;若将上述溶液250g蒸发掉50g水降至10℃,蒸发、降温都要析出五水硫酸铜晶体,根据溶解度公式计算即可.
解答 解:10g无水硫酸铜得五水硫酸铜10×$\frac{250}{160}$=15.625,需要水为5.625
硫酸铜的溶解度:30℃时25g,则五水硫酸铜与水的比为
25×$\frac{250}{160}$:(100-25×$\frac{90}{160}$)=39.0625:85.9375
可析出晶体的质量为5.625×$\frac{39.0625}{85.9375}$+15.625=18.18g
30℃时250g溶液中含五水硫酸铜250×$\frac{25}{100+25}$×$\frac{250}{160}$=78.125,溶剂水为250×$\frac{100}{100+25}$=200g
五水硫酸铜中的水为78.125×$\frac{90}{250}$=28.125
蒸发掉50g水之后总的水,共剩下200-50=150g
再除去五水硫酸铜中的水28.125,还剩下121.875g
10℃时121.875g的水能溶解的五水硫酸铜为
121.875×$\frac{17.4}{100-17.4×\frac{9}{16}}$×$\frac{250}{160}$=36.73g
两者之差即可析出晶体质量 78.125g-36.73g=41.40g.
故答案为:18.18g;41.40g.
点评 本题考查溶解度的计算,难度不大,注意硫酸铜溶液析出的是五水硫酸铜晶体.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
10.下列反应中属于吸热反应的是( )
| A. | 甲烷燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 氧化钙与水反应 |
11.下列化学用语所表示的微粒中,不能与盐酸发生化学反应的是( )
| A. |  | B. | ${\;}_{11}^{23}$Na | C. |  | D. | Mg |
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
15.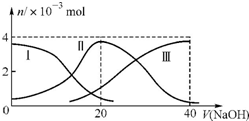 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
5.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
9.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 加热氯酸钾使其分解 | ||
| C. | 干冰升华 | D. | 二氧化硅熔化 |
10.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀溶液的pH,测定值可能偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |


 .
.