题目内容
3.在一密闭容器中进行反应2SO2+O2?2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为2mol•L-1、1mol•L-1、2mol•L-1.当反应达到平衡时,容器内各物质的浓度可能为( )| A. | SO2为4 mol•L-1、O2为2 mol•L-1 | B. | SO3为4 mol•L-1 | ||
| C. | SO2为2.5 mol•L-1 | D. | SO2、SO3为1.5 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为2mol/L、1mol/L,实际变化应小于该值,故A错误;
B、SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为2mol/L,实际变化小于该值,故B错误;
C、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为2mol/L,实际变化为0.5mol/L,小于2mol/L,故C正确;
D、反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故D错误.
故选C.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1 mol N5+含有的电子数为34NA | |
| D. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA |
14.下列各组元素的原子序数中,其相应的元素原子能形成XY2型共价化合物的是( )
| A. | 3与8 | B. | 6与8 | C. | 1与16 | D. | 12与17 |
11.下列化学用语所表示的微粒中,不能与盐酸发生化学反应的是( )
| A. |  | B. | ${\;}_{11}^{23}$Na | C. | 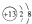 | D. | Mg |
8.已知反应A?2B,A、B的浓度变化如图所示,下列反应速率正确的是( )

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
15.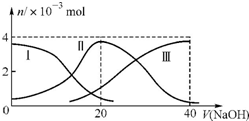 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
13.下列说法中正确的一组是( )
| A. | 正丁烷和异丁烷是同系物 | B. | 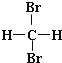 和 和 互为同分异构体 互为同分异构体 | ||
| C. | H2和D2互为同位素 | D. | 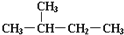 和 和  是同一种物质 是同一种物质 |
 .
. .
. .
.


 .
.