题目内容
【题目】下列事实不能用勒夏特列原理解释的是
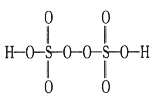
A.将Na2S 溶液加入到含Hg2+的废水中,可生成HgS 沉淀
B.将 AlCl3 溶液加热、蒸干、灼烧,最终得到 Al2O3
C.工业合成氨选择高压而不是常压作为反应条件
D.用稀H2SO4 洗涤 BaSO4 沉淀,可减少沉淀损失量
【答案】A
【解析】
A.将Na2S溶液加入到含Hg2+的废水中,发生S2-+Hg2+=HgS![]() 反应,可生成HgS 沉淀,不能用勒夏特列原理解释,故A符合题意;
反应,可生成HgS 沉淀,不能用勒夏特列原理解释,故A符合题意;
B.在AlCl3溶液中存在:Al3++3H2O![]() Al(OH)3+3H+水解平衡,加热促进水解,平衡正向移动,产生Al(OH)3沉淀,符合勒夏特列原理,蒸干、灼烧Al(OH)3,发生2Al(OH)3
Al(OH)3+3H+水解平衡,加热促进水解,平衡正向移动,产生Al(OH)3沉淀,符合勒夏特列原理,蒸干、灼烧Al(OH)3,发生2Al(OH)3![]() Al2O3+3H2O反应,最终得到Al2O3,故B不符合题意;
Al2O3+3H2O反应,最终得到Al2O3,故B不符合题意;
C.工业合成氨的反应为:N2+3H2![]() 2NH3,增大压强,平衡正向移动,促进氨气的生成,符合勒夏特列原理,故C不符合题意;
2NH3,增大压强,平衡正向移动,促进氨气的生成,符合勒夏特列原理,故C不符合题意;
D. BaSO4在溶液中存在:BaSO4(s)![]() Ba2-(aq)+SO42-(aq),用稀H2SO4洗涤沉淀,增大SO42-离子的浓度,平衡逆向移动可减少沉淀损失量,符合勒夏特列原理,故D不符合题意;
Ba2-(aq)+SO42-(aq),用稀H2SO4洗涤沉淀,增大SO42-离子的浓度,平衡逆向移动可减少沉淀损失量,符合勒夏特列原理,故D不符合题意;
故答案为A。

【题目】无水硫酸铜(CuSO4)为白色或灰白色粉末。其水溶液显蓝色,呈弱酸性。可用作杀菌剂和电解精炼铜时的电解液。某化学课外活动小组通过设计硫酸铜受热分解的探究实验,测定气体产物的成分(已知硫酸铜完全分解,固体产物仅含CuO)。实验装置如图所示,回答下列问题

(1)实验前需进行的操作是_________,仪器a的名称是_____,加热时试管外壁必须干燥,要先均匀加热,再集中加热,其目的是__________。
(2)实验结束时根据f中量筒是否收集到水,确定气体产物中有无_______(填化学式)。
(3)装置c的作用是_________。
(4)装置d中的化学方程式为____,_____。有小组成员建议在装置d后增加连接一个干燥管,其原因是_______。
(5)按完善装置的实验结束前后测得相关数据如下:(填化学式)。
实验前无水硫酸铜的质量/g | 实验后装置d增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
6.4 | 2.56 | 224 |
通过计算,写出CuSO4受强热分解的化学方程式:______。