题目内容
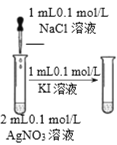
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素的最高价氧化物对应水化物的化学式分别为![]() 和
和![]() 。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
A.原子半径:![]()
B.氢化物稳定性:![]()
C.原子核内质子数:![]()
D.最高价氧化物对应水化物的碱性:![]()
【答案】A
【解析】
A.X、Y同周期,两种元素的最高价氧化物对应水化物分别为![]() (X显+6价)和
(X显+6价)和![]() (Y显+7价),所以X在Y元素的左边,原子半径:
(Y显+7价),所以X在Y元素的左边,原子半径:![]() ,故A正确;
,故A正确;
B.根据A项分析,非金属性:![]() ,非金属性越强,气态氢化物的稳定性越强,则氢化物稳定性:
,非金属性越强,气态氢化物的稳定性越强,则氢化物稳定性:![]() ,故B错误;
,故B错误;
C.R与冷水即可反应,M与热水反应缓慢,说明R、M的金属性:![]() ,R排在M的下面,原子核内质子数:
,R排在M的下面,原子核内质子数:![]() ,故C错误;
,故C错误;
D.根据C项分析,金属性:![]() ,金属性越强,最高价氧化物对应水化物的碱性越强,则最高价氧化物对应水化物的碱性:M<R,故D错误;
,金属性越强,最高价氧化物对应水化物的碱性越强,则最高价氧化物对应水化物的碱性:M<R,故D错误;
答案选A。

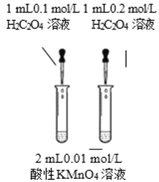
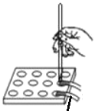
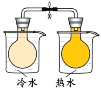
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
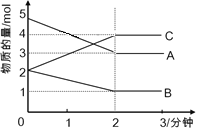
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
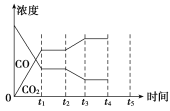
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变