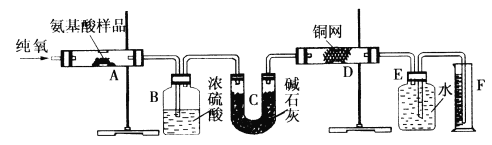
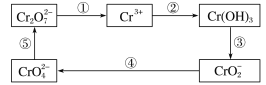
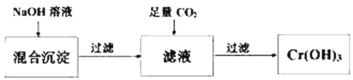
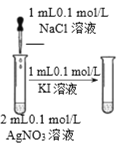
��Ŀ����
����Ŀ��ij�¶��£���2L���ܱ������У�X��Y��Z����������ʱ��仯��������ͼ��ʾ����ش���������
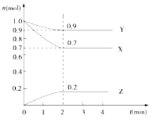
��1����ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ___________________________
��2����Ӧ��ʼ��2min��Z��ƽ����Ӧ����Ϊ________
��3��3minʱ��Z������������Z������������Ƚϣ�ǰ��________��������������С�������������������ߣ�
��4��������Ӧ���й����У���������¶ȣ����䷴Ӧ����________����������������С����������������
��5�����и����в�����˵��������Ӧ�ﵽƽ�����________������ĸ����
a������1molZ��ͬʱ����1.5molX b. X��Y��Z�ķ�Ӧ����֮��Ϊ3:2:1
c��ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ���� d��X��Ũ�ȱ��ֲ���
���𰸡�3X+Y![]() 2Z
2Z ![]() ��� ��С acd
��� ��С acd
��������
��1����ͼ���֪����Ӧ��X��Y�����ʵ������٣�ӦΪ��Ӧ�Z�����ʵ������࣬ӦΪ���������Ӧ���е�2minʱ��X��Y�����ʵ��������Ҳ�Ϊ0�����ڿ��淴Ӧ����n(X)=0.3mol����n(Y)=0.1mol����n(Z)=0.2mol�����n(X):��n(Y):��n(Z)=3:1:2���μӷ�Ӧ�����ʵ����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ�ķ���ʽΪ��3X+Y![]() 2Z��
2Z��
��2����Ӧ��ʼ��2min��Z��ƽ����Ӧ����Ϊ ��
��
��3��3minʱ�ﵽƽ��״̬��3minʱZ����������������������ȣ�
��4���¶Ƚ��ͣ���λ����ڻ�������ή�ͣ������˶����ʻή�ͣ���Ч��ײƵ�ʻή�ͣ���ѧ��Ӧ���ʻ��С��
��5��a������1molZ��ʾ����Ӧ���ʣ�����1.5molX��ʾ����Ӧ���ʣ���������֮�ȵ���2:3�����Ӧ���ʵ�ϵ��֮����ȣ���˵����Ӧ�ﵽƽ��״̬����a�������⣻
b��δȷ���÷�Ӧ���ʱ�ʾ����������ж����淴Ӧ�����Ƿ���ȣ���˲���ȷ����Ӧ�Ƿ�ﵽƽ��״̬���Ҵ���ƽ��״̬ʱ����X��Y��Z�ķ�Ӧ����֮��Ϊ3:1:2����b���������⣻
c��ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ���ʣ�˵�������ʵ�Ũ�Ȳ��ٷ����仯����˵����Ӧ����ƽ��״̬����c�������⣻
d��X��Ũ�ȱ��ֲ��䣬��˵�����淴Ӧ������ȣ���˵����Ӧ�ﵽƽ��״̬����d�������⣻
�ʴ�Ϊ��acd��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʵ�鷽�����ܴﵽ��Ӧʵ��Ŀ�ĵ���
A | B | C | D | |
���� |
|
|
��ʪ��pH��ֽ |
�� NO2��ֱ��������ˮ����ˮ�� |
Ŀ �� | ֤��AgI ��AgCl������ | ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� | �ⶨ��Һ�� pH | ̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� |
A.AB.BC.CD.D