题目内容
【题目】央视报道《王者归“铼”》:中国发现超级金属“铼”,飞机火箭上天全靠它,有望打破美国垄断。
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,已知Mn的外围电子排布式为3d54s2,写出75Re的外围电子排布式:______,其最高价氧化物的化学式为_______。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
(3)实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
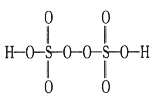
上述反应中S2O82-断裂的共价键类型为___(填“σ键”或“π键”),每生成0.3molMnO4-,过硫酸根中断裂的共价键数目为_____NA。
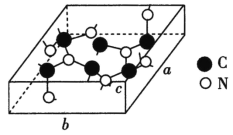
(4)科学家研制出一种新型的超硬材料,类似于金刚石的结构,但硬度比金刚石大,该晶体元素组成为C和N,其晶胞如图所示(图示原子都包含在晶胞内),则该晶胞所含氮原子的个数为____。已知晶胞参数分别为a nm、b nm、c nm,,该晶体的摩尔质量为Mg·mol-1,密度为ρg·cm-3,则阿伏加德罗常数的数值为___(用含a、b、c、ρ、M的代数式表示)。
【答案】5d56s2 Re2O7 sp3 sp2 O σ 0.75 8 ![]()
【解析】
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,锰元素为25号元素,铼为75号元素位于第6周期第ⅤⅡB族,结合Mn的外围电子排布式为3d54s2,75Re的外围电子排布式:5d56s2,最高价为+7价,据此写出氧化物化学式为Re2O7。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,甲醇分子内碳原子形成4个σ键,杂化方式为sp3杂化,甲醛(H2C=O)分子内碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化;同周期元素从左到右元素的电负性逐渐增大,电负性C<O,H的电负性最小,H<C<O,则O原子电负性最大。
HCHO+H2↑,甲醇分子内碳原子形成4个σ键,杂化方式为sp3杂化,甲醛(H2C=O)分子内碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化;同周期元素从左到右元素的电负性逐渐增大,电负性C<O,H的电负性最小,H<C<O,则O原子电负性最大。
(3)反应中S2O82-中过氧键发生断裂生成SO42-,断裂的是σ键,每生成1mol MnO4-消耗S2O82-为1mol×![]() =2.5mol,每生成0.3mol MnO4-,反应中S2O82-中过氧键发生断裂生成SO42-,故断裂0.75NA个过氧键非极性键;
=2.5mol,每生成0.3mol MnO4-,反应中S2O82-中过氧键发生断裂生成SO42-,故断裂0.75NA个过氧键非极性键;
(4)图示原子都包含在晶胞内,该晶体元素组成为C和N,每个晶胞中含有6个C原子,8个N原子;每个晶胞含2个C3N4,每个晶胞质量=![]() g,每个晶胞的体积为abc×10-21cm3,则密度ρ=
g,每个晶胞的体积为abc×10-21cm3,则密度ρ=![]() =
=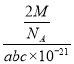 g·cm-3,NA=
g·cm-3,NA=![]() 。
。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案