题目内容
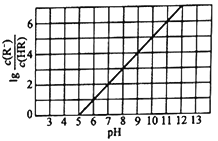
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
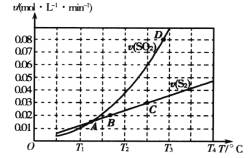
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
【答案】B
【解析】
A.升高温度平衡向吸热方向移动,C点对应温度升高到D点对应温度,SO2的生成速率与S2(g)的生成速率之比大于2∶1,说明SO2的生成速率大于其本身消耗速率,平衡逆向移动,即逆反应是吸热反应,则正反应是放热反应,△H<0,故A错误;
B.达到平衡状态时,SO2的生成速率与S2(g)的生成速率之比为2∶1,根据图知,只有C点符合,故B正确;
C.能够增大SO2平衡转化率说明平衡正向移动,但不能是增加C的物质的量,因为C为固体,故C错误;
D. 增大压强,增大了单位体积内的活化分子数,但活化分子百分数不变,故D错误;
答案选B。

 阅读快车系列答案
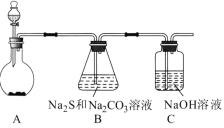
阅读快车系列答案【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
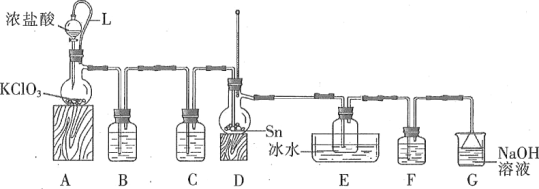
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
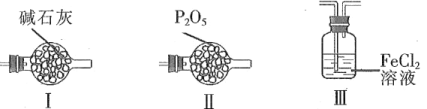
(4)F和G装置可以用下列装置代替的是____。(填代号)
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-