题目内容
【题目】25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A.pH=10 的Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.pH=13 的氨水与pH=1 的盐酸等体积混合:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>c(![]() )
)
【答案】B
【解析】
A.根据质子守恒可知,Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3),故A正确;
)+c(H+)+2c(H2CO3),故A正确;
B.pH=13 的氨水与pH=1 的盐酸等体积混合后氨水过量,溶液呈碱性,c(![]() )>c(Cl-)>c(OH-)>c(H+),故B错误;
)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液,根据电荷守恒得c(Na+)+ c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),因中性溶液中c(H+)=c(OH-),则c(Na+)=2c(
)+c(OH-),因中性溶液中c(H+)=c(OH-),则c(Na+)=2c(![]() )+c(
)+c(![]() ),故C正确;
),故C正确;
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合恰好完全反应产生等浓度的一水合氨和氯化钠,因此c(Na+)=c(Cl-),而一水合氨弱碱不完全电离,结合水的电离可知,c(OH-)>c(![]() ),故c(Na+)=c(Cl-)>c(OH-)>c(
),故c(Na+)=c(Cl-)>c(OH-)>c(![]() ),故D正确;
),故D正确;
故选:B。

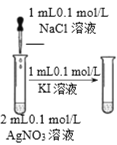
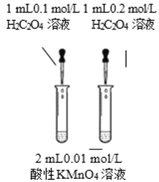
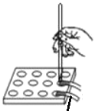
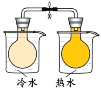
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
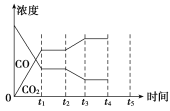
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变