��Ŀ����
����Ŀ�������������ڹ�ũҵ�����ж�����ҪӦ�á�
��1���£�N2H4���������ᷴӦ�����ɵ�����һ���⻯��ڱ�״���£����⻯��������ܶ�Ϊ1.92g/L�������е�Ԫ�ص���������Ϊ0.977����÷�Ӧ�Ļ�ѧ����ʽΪ____.
��2������������һ�������£����Է������·�Ӧ��SO2(g)+NO2(g)![]() SO3(g)+NO(g) ��H= -42kJ��mol-1����2L�ĺ����ܱ������г���SO2(g)��NO2(g)����ʵ���������£�
SO3(g)+NO(g) ��H= -42kJ��mol-1����2L�ĺ����ܱ������г���SO2(g)��NO2(g)����ʵ���������£�
ʵ���� | �¶� | ��ʼ���ʵ���mol | ƽ��ʱ���ʵ���/mol | |
n(SO2) | n(NO2) | n(NO) | ||
�� | T1 | 4.0 | 1.0 | 0.9 |
�� | T2 | 1.0 | 4.0 | 0.8 |
�� | T2 | 0.4 | 0.6 | a |
����ʵ����У���2minʱ��÷ų���������8.4kJ��0��2minʱ���ڣ���SO2��ʾ��ƽ����Ӧ����v(SO2)=_______________�����¶��µ�ƽ�ⳣ��Ϊ_________�������������С�������λ��
���ɱ������ݿ���֪��T1_______T2������>����<������=����
��ʵ����У��ﵽƽ��ʱNO2��ת����Ϊ______________.
��3����ҵ�Ͽ����ð�ˮ��SO2ת��ΪNH4HSO3����������(NH4)2SO4�������²��NH4HSO3��ҺpHΪ6������Һ��![]() ________________________.����֪��H2SO3��Kal =1.5��10-2Ka2 =1.0��10-7��
________________________.����֪��H2SO3��Kal =1.5��10-2Ka2 =1.0��10-7��
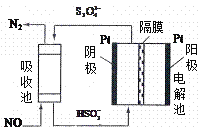
��4��ʹ�ü�ӵ绯ѧ�����Դ���ú�����е�NO��װ����ͼ����֪������Һ��pH��4��7֮�䣬д�������ĵ缫��Ӧʽ__________________��
 ��
��
���𰸡� N2H4+HNO2��HN3+2H2O 0.05 mol��L-1��min-1 2.61 �� 40�� 1500 2HSO3��+2e����S2 O42��+2OH����2HSO3��+2e��+2H+��S2 O42��+2H2O
����������1���£�N2H4���������ᷴӦ�����ɵ�����һ���⻯��ڱ�״���£����⻯��������ܶ�Ϊ1.92g/L������⻯���Ħ������Ϊ![]() ����֪���е�Ԫ�ص���������Ϊ0.977������⻯�������Nԭ�ӵ���ĿΪ
����֪���е�Ԫ�ص���������Ϊ0.977������⻯�������Nԭ�ӵ���ĿΪ![]() ����ˣ������ʽΪHN3���÷�Ӧ�Ļ�ѧ����ʽΪN2H4+HNO2��HN3+2H2O.
����ˣ������ʽΪHN3���÷�Ӧ�Ļ�ѧ����ʽΪN2H4+HNO2��HN3+2H2O.
��2������ʵ����У���2minʱ��÷ų���������8.4kJ����0��2minʱ����SO2�ı仯��Ϊ0.2mol����SO2��ʾ��ƽ����Ӧ����v(SO2)=![]() 0.05 mol��L-1��min-1���ﵽƽ��ʱ��NO�ı仯��Ϊ0.9mol���������������ʵı仯��Ҳ��0.9mol��SO2��NO2��SO3��NO��ƽ�����ֱ�Ϊ3.1mol��0.1mol��0.9mol��0.9mol��SO2��NO2��SO3��NO��ƽ��Ũ�ȷֱ�Ϊ1.55mol/L��0.05mol/L��0.45mol/L��0.45mol/L�����¶��µ�ƽ�ⳣ��Ϊ
0.05 mol��L-1��min-1���ﵽƽ��ʱ��NO�ı仯��Ϊ0.9mol���������������ʵı仯��Ҳ��0.9mol��SO2��NO2��SO3��NO��ƽ�����ֱ�Ϊ3.1mol��0.1mol��0.9mol��0.9mol��SO2��NO2��SO3��NO��ƽ��Ũ�ȷֱ�Ϊ1.55mol/L��0.05mol/L��0.45mol/L��0.45mol/L�����¶��µ�ƽ�ⳣ��Ϊ![]() 2.61��
2.61��
���ɱ������ݿ�֪������Ͷ��������൱����NO��ƽ������С�����ҵ�ƽ�ⳣ����С�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ������T1��T2��
����ʵ���ҿ�������÷�Ӧ��T2�¶��µ�ƽ�ⳣ��Ϊ1����ʵ�����NO2��ת����Ϊx����NO2�ı仯��Ϊ0.6x�������������ʵı仯��Ҳ��0.6x��SO2��NO2��SO3��NO��ƽ��Ũ�ȷֱ�Ϊ0.2-0.3x��0.3-0.3x��0.3x��0.3x������![]() ����֮��x=0.4�����ԣ��ﵽƽ��ʱNO2��ת����Ϊ40��.
����֮��x=0.4�����ԣ��ﵽƽ��ʱNO2��ת����Ϊ40��.
��3�������²��NH4HSO3��ҺpHΪ6��c(![]() )
)![]() ��Kal
��Kal ![]() Ka2 =
Ka2 =![]() 1.5��10-2
1.5��10-2![]() 1.0��10-7=1.5��10-9������Һ��
1.0��10-7=1.5��10-9������Һ��![]() .
.
��4�������е������Һ��pH��4��7֮�䣬��ͼ����Ϣ��֪��HSO3���������ϱ���ԭΪS2 O42�����������ĵ缫��Ӧʽ2HSO3��+2e����S2 O42��+2OH����2HSO3��+2e��+2H+��S2 O42��+2H2O��

����Ŀ���¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5 �� ��ӦPCl5��g��PCl3��g��+Cl2��g������һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ�IJ������ݼ���������˵����ȷ���ǣ�������
t/s | 0 | 50 | 150 | 250 | 350 |
n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.��Ӧ��ǰ50s��ƽ������v��Cl2��=0.0016 molL��1min��1
B.���������������䣬�����¶ȣ�ƽ��ʱc��PCl3��=0.11 molL��1 �� ��÷�Ӧ�ġ�H��0
C.�¶�ΪTʱ����ʼʱ�������г���1.0 mol PCl5��0.20 mol PCl3��0.20 mol Cl2 �� ��Ӧ�ﵽƽ��ǰv��������v���棩
D.�¶�ΪTʱ����ʼʱ�������г���0.5 mol PCl3��0.5 mol Cl2 �� �ﵽƽ��ʱ��PCl3��ת����С��80%
����Ŀ����298 Kʱ��ʵ������Һ�еķ�ӦH2O2��2HI===2H2O��I2�ڲ�ͬŨ��ʱ�Ļ�ѧ��Ӧ���������ʾ���ɴ˿���֪��5��ʵ����c(HI)��c(H2O2)������Ϊ
ʵ���� | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol��L��1) | 0.100 | 0.200 | 0.150 | 0.100 | �� | 0.500 |
c(H2O2)/(mol��L��1) | 0.100 | 0.100 | 0.150 | 0.200 | �� | 0.400 |
v/(mol��L��1��s��1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol��L��1��0.200 mol��L��1
B. 0.300 mol��L��1��0.100 mol��L��1
C. 0.200 mol��L��1��0.200 mol��L��1
D. 0.100 mol��L��1��0.300 mol��L��1