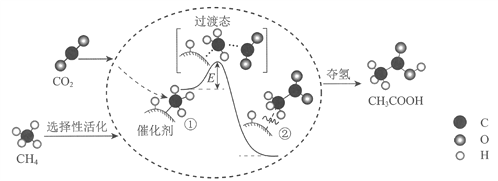
题目内容
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g)△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应
【答案】D
【解析】解:A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)= ![]() =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)= ![]() ×v(HCl)=
×v(HCl)= ![]() ×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
D.由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为: ![]() =0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
A.增大平衡向气体体积减小的方向移动,据此判断;
B.该反应为可逆反应,1molSiCl4不能完全转化,结合热化学方程式判断;
C.根据v= ![]() 计算v(HCl),利用速率之比等于化学计量数之比计算判断;
计算v(HCl),利用速率之比等于化学计量数之比计算判断;
D.根据反应吸收的热量计算生成的HCl的物质的量,据此判断.

【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
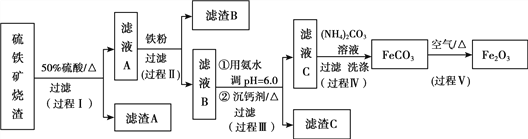
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
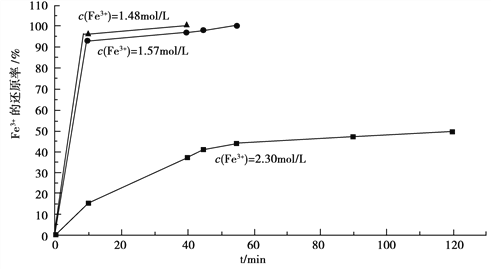
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
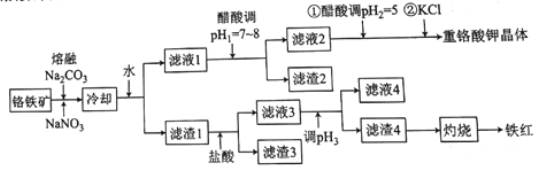
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。