题目内容
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
【答案】
(1)Na2CO3溶液>NaCN溶液>CH3COONa溶液
(2)>
(3)NaCN+H2O+CO2=HCN+NaHCO3
(4)9.9×10﹣7mol/L
【解析】解:(1)依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度等浓度的Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;
所以答案是:Na2CO3溶液>NaCN溶液>CH3COONa溶液;(2)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H+)<c(OH﹣)依据溶液中电荷守恒c(H+)+c(Na+)=c(OH﹣)+c(CH3COO﹣),c(Na+)>c(CH3COO﹣);
所以答案是:>;(3)向NaCN溶液中通入少量CO2 ,H2CO3酸性大于HCN大于HCO3﹣,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;
所以答案是:NaCN+H2O+CO2=HCN+NaHCO3;(4)25℃时,pH=8的CH3COONa溶液中,c(H+)=10﹣8mol/L,c(OH﹣)= ![]() =10﹣6mol/L,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
=10﹣6mol/L,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
c(Na+)﹣c(CH3COO﹣)=c(OH﹣)﹣c(H+)=10﹣6mol/L﹣10﹣8mol/L=9.9×10﹣7 mol/L,
所以答案是:9.9×10﹣7 mol/L.
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50s的平均速率v(Cl2)=0.0016 molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 molL﹣1 , 则该反应的△H<0
C.温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2 , 反应达到平衡前v(正)<v(逆)
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2 , 达到平衡时,PCl3的转化率小于80%
【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
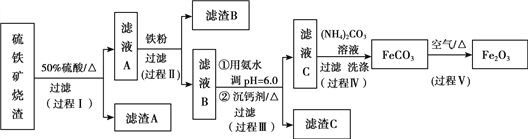
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
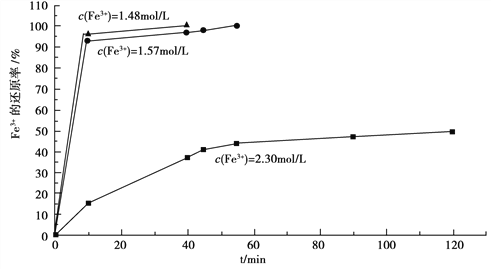
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。


