题目内容
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
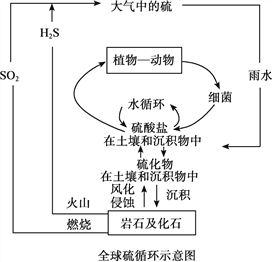
(1)火山喷发产生H2S在大气当中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △H=﹣297.04kJ/mol。
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是__________。
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),请从沉淀溶解平衡的角度解释由ZnS转变为CuS的过程__________。
(3)化石燃料燃烧时会产生含SO2的废气进入大气,污染环境,有多种方法可用于SO2的脱除。
①氨法脱硫。该方法是一种高效低耗能的湿法脱硫方式,利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,得到化肥产品。反应的化学方程式是__________。
②NaClO碱性溶液吸收法。工业上可用NaClO碱性溶液吸收SO2。反应离子方程式是__________。为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示:
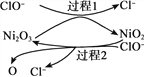
过程1:Ni2O3 +ClO- = 2NiO2 +Cl-,过程2的离子方程式是__________。
Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是__________。
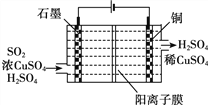
③电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除SO2还可得到Cu。电解过程中发生总反应的离子方程式是__________。
【答案】 2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移 4NH3·H2O +2SO2+O2===2(NH4)2SO4+2H2O ClO-+SO2+2OH- =Cl-+SO42-+H2O 2NiO2+ClO- ===Ni2O3 +Cl-+2O Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行 2H2O +Cu2++SO2
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移 4NH3·H2O +2SO2+O2===2(NH4)2SO4+2H2O ClO-+SO2+2OH- =Cl-+SO42-+H2O 2NiO2+ClO- ===Ni2O3 +Cl-+2O Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行 2H2O +Cu2++SO2![]() Cu+SO42—+4H+
Cu+SO42—+4H+
【解析】(1)①2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=﹣442.38kJ/mol,②S(g)+O2(g)=SO2(g)△H=﹣297.04kJ/mol,根据盖斯定律,将①+②×2得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=(﹣442.38kJ/mol)+(﹣297.04kJ/mol)×2=﹣1036.46kJ/mol,故答案为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol;
(2)ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移,因此自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),故答案为:ZnS(s)
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移,因此自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),故答案为:ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移;
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移;
(3)①利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,反应的化学方程式为,4NH3·H2O +2SO2+O2=2(NH4)2SO4+2H2O故答案为:4NH3·H2O +2SO2+O2=2(NH4)2SO4+2H2O;
②用NaClO碱性溶液吸收SO2,次氯酸钠将二氧化硫氧化生成硫酸,反应离子方程式是ClO-+SO2+2OH- =Cl-+SO42-+H2O;为了提高吸收效率,常用Ni2O3作为催化剂。根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为2NiO2+ClO- =Ni2O3 +Cl-+2O;Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,是因为Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行,故答案为:ClO-+SO2+2OH- =Cl-+SO42-+H2O;2NiO2+ClO- =Ni2O3 +Cl-+2O;Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行;
③根据图示,二氧化硫与硫酸铜在通电作用下反应生成了硫酸和铜,反应的离子方程式为2H2O +Cu2++SO2![]() Cu+SO42—+4H+,故答案为:2H2O +Cu2++SO2
Cu+SO42—+4H+,故答案为:2H2O +Cu2++SO2![]() Cu+SO42—+4H+。
Cu+SO42—+4H+。

【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1