题目内容
18.下列关于硅及其化合物的叙述中,不正确的是( )| A. | 晶体硅常用作半导体材料 | B. | 二氧化硅不能与任何酸反应 | ||
| C. | 硅在地壳中主要以化合态形式存在 | D. | 硅酸可通过硅酸钠与盐酸反应制得 |
分析 A.晶体硅导电性介于导体与绝缘体之间;
B.二氧化硅与氢氟酸常温下能够反应;
C.硅在自然界中不能以游离态存在;
D.依据强酸制取弱酸规律解答.
解答 解:A.晶体硅导电性介于导体与绝缘体之间,是良好的半导体材料,故A正确;
B.二氧化硅与氢氟酸常温下能够反应生成四氟化硅和水,故B错误;
C.硅在地壳中主要以化合态形式存在,自然界中不存在游离态硅,故C正确;
D.盐酸的酸性强于硅酸,所以盐酸与硅酸钠反应生成硅酸,故D正确;
故选:B.
点评 本题考查了元素化合物知识,熟悉硅及其化合物的性质是解题关键,注意硅在自然界中的存在形态.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
6.下列有关热化学方程式的叙述正确的是( )
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
13.下列做法不能有效改善大气质量的是( )
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
3.下列有关反应2NO+2CO$\frac{\underline{\;催化剂\;}}{△}$N2+CO2的叙述中,正确的是( )
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
10.下列反应过程中的能量变化情况符合如图的是( )
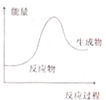

| A. | 乙醇的燃烧 | B. | 碳酸钙的分解 | ||
| C. | 镁和盐酸的反应 | D. | 酸和碱的中和反应 |
8.下列指定反应的离子方程式正确的是( )
| A. | 向硫酸铜溶液中加入NaHS溶液:Cu2++HS-=CuS↓+H+ | |
| B. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-=2NO3-+H2O | |
| D. | 将少量SO2气体通入氨水中:SO2+NH3•H2O=NH4++HSO3- |
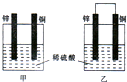 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.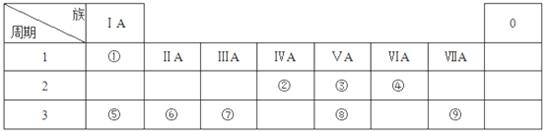
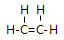 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为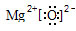 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为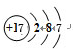 .
.