题目内容
4.用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了6.5克,铜表面析出了氢气2.24L(标准状况下).导线中通过0.2 mol电子;SO42-向负极(填正极或负极)移动,溶液的pH值增大(填增大或减小);正极的电极反应是2H++2e-=H2↑,用离子方程式表示电极的总反应式Zn+2H+=Zn2++H2↑.分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应式为2H++2e-=H2↑,结合原电池工作原理及电极反应式进行相关的计算.
解答 解:锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应式为2H++2e-=H2↑,锌片的质量减少了6.5克,n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,铜表面析出了氢气为0.1mol×22.4L/mol=2.24L,导线上通过0.2mol电子时,SO42-向负极移动,氢离子浓度减小,则溶液的pH值增大;用离子方程式表示电极的总反应式为Zn+2H+=Zn2++H2↑,
故答案为:2.24;0.2;负极;增大;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑.
点评 本题考查原电池知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握电极反应式的书写,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
15.下列表示物质结构的化学用语或模型图正确的是( )
| A. | 二氧化碳的电子式: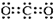 | B. | 14C的原子结构示意图: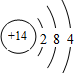 | ||
| C. | C3H8的结构式CH3-CH2-CH3 | D. | 次氯酸的电子式: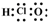 |
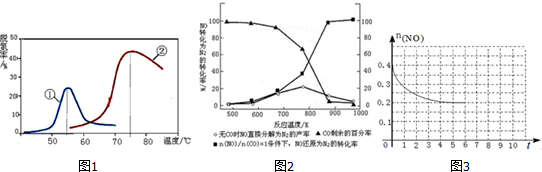
19. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
据此可判断( )
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
| A. | a<b | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 上述反应是放热反应 |
1. 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
18.下列关于硅及其化合物的叙述中,不正确的是( )
| A. | 晶体硅常用作半导体材料 | B. | 二氧化硅不能与任何酸反应 | ||
| C. | 硅在地壳中主要以化合态形式存在 | D. | 硅酸可通过硅酸钠与盐酸反应制得 |
19.下列说法不正确的是( )
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
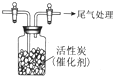 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.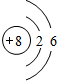 C的离子结构示意图:
C的离子结构示意图: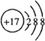 .
.