题目内容
6.下列有关热化学方程式的叙述正确的是( )| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
分析 A、依据盖斯定律应用条件和热化学方程式计算分析;
B、热化学方程式计量数减半,焓变随之减半;
C、反应是放热反应,硫单质燃烧生成稳定氧化物二氧化硫,二氧化硫生成三氧化硫条件不同,稳定性不能比较;
D、△H=反应物的键能和-生成物的键能和,结合化学方程式计算得到反应焓变,依据热化学方程式书写方法写出对应热化学方程式.
解答 解:A、若C(s)+O2(g)=CO2(g)△H1,①
CO2(g)+C(s)=2CO(g)△H2,②
2CO(g)+O2(g)=2CO2(g)△H3,③
相同条件下,则反应热的关系依据盖斯定律计算①=②+③:△H1=△H2+△H3,故A正确;
B、若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=2△H5,故B错误;
C、若2SO2(g)+O2(g)=2SO3(g)△H<O,硫单质燃烧生成稳定氧化物二氧化硫,二氧化硫生成三氧化硫条件不同,稳定性不能比较,故C错误;
D、已知2H2(g)+O2(g)═2H2O(g),△H=反应物的键能和-生成物的键能和=2×436kJ•mol-1+498KJ/mol-4×463kJ•mol-1=-482kJ•mol-1,
△H=-482kJ•mol-1,O2(g)与H2(g)反应生成H2O(g)的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-482kJ•mol-1,故D正确;
故选AD.
点评 本题考查了热化学方程式书写方法,物质稳定性比较依据,注意盖斯定律计算应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.N2H4是一种重要的火箭燃料,能在空气中燃烧生成氮气和水,放出大量的热.室温时,已知各共价键的键能如下表,通过计算N2H4的燃烧热是( )
| 键 | N-H | N-N | O=O | N≡N | H-O |
| 键能/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A. | 1088 kJ•mol-1 | B. | 544 kJ•mol-1 | C. | 790 kJ•mol-1 | D. | 382 kJ•mol-1 |
1. 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4,则△H4=-2317.0kJ•mol-1.
(2)亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
(3)一定温度下,将a mol/L的氨水与b mol/LH2SO4溶液等体积混合,充分反应后有:2c(SO42-)=c(NH4+),用含a和b的代数式表示该混合溶液中NH3•H2O的电离常数为$\frac{2b}{a-2b}$×10-7.
(4)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体,写出该反应的离子方程式:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
18.下列关于硅及其化合物的叙述中,不正确的是( )
| A. | 晶体硅常用作半导体材料 | B. | 二氧化硅不能与任何酸反应 | ||
| C. | 硅在地壳中主要以化合态形式存在 | D. | 硅酸可通过硅酸钠与盐酸反应制得 |
15.下列关于铝及其化合物的叙述正确的是( )
| A. | Al是地壳中含量最多的元素 | |
| B. | Al2O3的熔点很高,是一种较好的耐火材料 | |
| C. | 向Al2(SO4)3溶液中滴加过量NaOH溶液制备Al(OH3) | |
| D. | 铝制品在生活中被广泛使用,说明铝是一种不活泼的金属 |
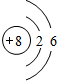 C的离子结构示意图:
C的离子结构示意图: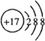 .
.