题目内容
3. 锌是一种较活泼的金属,具有广泛的用途.
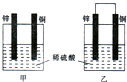
锌是一种较活泼的金属,具有广泛的用途.(1)把纯净的锌片和铜片平行地插入盛有稀硫酸的烧杯中(如图甲所示),可观察到铜片上有2H++2e-=H2↑,(填“有”或“无”)气泡产生.
(2)将(1)中的锌片和铜片用导线连接起来(如图乙所示),可观察到铜片上有气泡产生,产生气泡的原因是2H++2e-=H2↑(用电极反应式表示).
(3)若(2)中最初装入的是500mL 2mol•L-1稀硫酸,当收集到标准状况下11.2L氢气时(假设产生的气体没有损失),烧杯内剩余H2SO4的物质的量浓度为(溶液体积变化忽略不计)1mol•L-1.
(4)科学家以反应2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内为心脏起搏器提供能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,该原电池的负极材料是锌,负极的电极反应式为2Zn-4e-═2Zn2+.
分析 (1)如果不用导线连接Zn和Cu,该装置不能构成原电池,锌发生化学腐蚀;如果用导线把锌片和铜片连接起来(如图乙所示),该装置构成原电池,Zn作负极、Cu作正极,正极上氢离子放电;
(2)将(1)中的锌片和铜片用导线连接起来(如图乙所示),可观察到铜片上有气泡产生,是因为构成原电池,电极反应式为:2H++2e-=H2↑;,
(3)当在标准状况下收集到11.2L的氢气时,硫酸剩余,电解质为硫酸和硫酸锌,结合电极方程式计算.
(4)根据电池反应式知,锌失电子发生氧化反应而作负极
解答 解:(1)如果不用导线连接Zn和Cu,该装置不能构成原电池,锌发生化学腐蚀,Cu和稀硫酸不反应,所以Cu片上没有气泡产生;如果用导线把锌片和铜片连接起来,该装置构成原电池,Zn作负极、Cu作正极,正极上氢离子得电子生成氢气,所以观察到铜片上有气泡产生,
故答案为:有;
(2)将(1)中的锌片和铜片用导线连接起来(如图乙所示),可观察到铜片上有气泡产生,是因为构成原电池,氢离子放电,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)当收集到11.2L H2(标准状况),即0.5mol H2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,c(H2SO4)=$\frac{0.5L×2mol•{L}^{-1}-0.5mol}{0.5L}$=1mol•L-1,故答案为:c(H2SO4)=1mol•L-1;
(4)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,故答案为:锌;2Zn-4e-═2Zn2+.
点评 本题考查了探究原电池构成条件、电极反应式的书写等知识点,根据甲、乙判断移动构成条件,同时考查学生分析问题、总结归纳能力,题目难度不大.

| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
| 键 | N-H | N-N | O=O | N≡N | H-O |
| 键能/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A. | 1088 kJ•mol-1 | B. | 544 kJ•mol-1 | C. | 790 kJ•mol-1 | D. | 382 kJ•mol-1 |
| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
①己烷 ②乙酸乙酯 ③溴苯 ④乙酸 ⑤甲苯 ⑥硝基苯.
| A. | ①②③ | B. | ①③⑤ | C. | ①②⑤ | D. | ①②⑤⑥ |
| A. | 二氧化碳的电子式: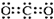 | B. | 14C的原子结构示意图: | ||
| C. | C3H8的结构式CH3-CH2-CH3 | D. | 次氯酸的电子式: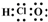 |
| A. | 晶体硅常用作半导体材料 | B. | 二氧化硅不能与任何酸反应 | ||
| C. | 硅在地壳中主要以化合态形式存在 | D. | 硅酸可通过硅酸钠与盐酸反应制得 |
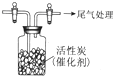 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究. C的离子结构示意图:
C的离子结构示意图: .
.