题目内容
2.理论上用50t褐铁矿(2Fe2O3•3H2O)能冶炼出多少吨含铁96%的生铁(设冶炼过程中损失铁为20%)分析 褐铁矿被还原生成Fe单质,根据碳原子守恒得关系式为2Fe2O3•3H2O----4Fe,根据关系式进行计算.
解答 解:褐铁矿被还原生成Fe单质,根据碳原子守恒得关系式为2Fe2O3•3H2O----4Fe,
设生成96%生铁的质量为x,
2Fe2O3•3H2O----4Fe
374 224
50t×(1-20%) 96%x
374:224=50t×(1-20%):96%x
x=$\frac{50t×(1-20%)×224}{374×96%}$=25t,
答:理论上用50t褐铁矿(2Fe2O3•3H2O)能冶炼出25吨含铁96%的生铁.
点评 本题考查化学方程式的有关计算,正确判断褐铁矿和铁的关系式是解本题关键,题目难度不大.

练习册系列答案
相关题目
13.25℃时,KNO3在水中的饱和溶液物质的量浓度是6mol•L-1,若将1mol固体KNO3置于1L水中,则KNO3变成盐溶液过程的△H-T△S的取值为( )
| A. | 小于0 | B. | 等于0 | C. | 大于0 | D. | 不能确定 |
10.称量NaOH固体的质量时,不能把它放在纸上称量而是放在已知质量的烧杯中进行称量的主要原因是( )
| A. | 因为放在烧杯中称量比放在纸上称量更准确 | |
| B. | 因为配制溶液是在烧杯中进行,直接放在烧杯中称量会减少操作过程 | |
| C. | 因NaOH易潮解且有强腐蚀性 | |
| D. | 因为放在纸上称量会混有杂质,降低所配制溶液的纯度 |
17.在加热情况下,用足量CO还原7g铁的氧化物组成的混合物,产生气体全部通入足量石灰水中得到12.5g沉淀,此混合物不可能为( )
| A. | FeO、Fe2O3 | B. | FeO、Fe3O4 | C. | Fe2O3、Fe3O4 | D. | FeO、Fe2O3、Fe3O4 |
7.1L 2mol/L NaOH溶液中取出0.6L,剩下的溶液的浓度为( )
| A. | 2mol/L | B. | 1.2mol/L | C. | 0.8mol/L | D. | 无法确定 |
11.下列每组中的三对物质都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | B. | 二溴乙烷和水,溴苯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | D. | 苯和水,甲苯和水,己烷和水 |
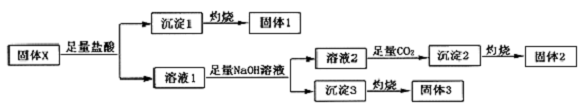
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.
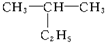 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.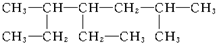 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.