题目内容
11.下列每组中的三对物质都能用分液漏斗分离的是( )| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | B. | 二溴乙烷和水,溴苯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | D. | 苯和水,甲苯和水,己烷和水 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,一般来说:有机溶质易溶于有机溶剂,无机溶质易溶于无机溶剂.
解答 解:A.乙酸乙酯和水不溶,苯酚和水不溶,能用分液漏斗进行分离,酒精和水互溶,不能用分液漏斗进行分离,故A错误;
B.二溴乙烷和水,溴苯和水不溶,能用分液漏斗进行分离,酒精和水互溶,不能用分液漏斗进行分离,故B错误;
C.甘油和水、乙醛和水、乙酸和乙醇互溶,不能用分液漏斗进行分离,故C错误;
D.苯和水,甲苯和水,己烷和水不互溶,都能用分液漏斗进行分离,故D正确.
故选D.
点评 本题考查了物质分离方法中的分液法,熟记物质的性质是解题的关键所在,难度不大.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
1.下列反应与酸性氧化物的通性无关的是( )
| A. | 实验室用碱石灰吸收SO2 | B. | CO2与澄清石灰水作用 | ||
| C. | N2O5与水反应制备HNO3 | D. | Na2O2与水反应制备氧气 |
19.利用碳酸钠晶体(Na2CO3•10H2O)来配制0.5mol•L-1的碳酸钠溶液1000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A. | 称取碳酸钠晶体100g | |
| B. | 定容时俯视观察刻度线 | |
| C. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤 | |
| D. | 定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
6.下列叙述正确的是( )
| A. | 直径介于1nm~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 用盐析法可分离皂化反应后所得的产物 | |
| D. | 用含1mol FeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
3.已知弱酸的电离平衡常数如下表:下列选项正确的是( )
| 弱酸 | H2CO3 | 水杨酸(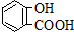 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于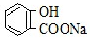 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和 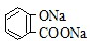 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→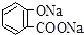 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
20.X、Y、Z、W、R是五种常见的前四周期元素,原子序数依次增大,其相关信息如下表:
(1)元素W在周期表中的位置是第三周期,第ⅥA族,R基态原子的价电子排布式为3d54s1.
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
| 元素 | 相关信息 |
| X | X单质分子中σ键和π键数目之比为1:2 |
| Y | Y 基态原子的最外层电子排布式为 nsnnpn+2 |
| Z | Z的第一电离能在同周期主族元素中最小 |
| W | W的氧化物是导致酸雨的主要物质之一 |
| R | 基态原子的核外电子排布中未成对的电子数最多 |
(2)Y的电离能比X的小(填“大”或“小”),Y的最简单氢化物由液态变为气态所需克服的微粒间作用力是氢键;
(3)ZX3受撞击会产生一种离子化合物和一种气态单质,该反应的化学方程式是3NaN3=Na3N+4N2↑.
(4)工业废水中含有的R2O72-离子,常用Fe2+将其还原为R3+离子,再通过调节溶液的pH值,使其转化为
氢氧化物沉淀除去.试写出酸性条件下R2O72-与Fe2+反应的离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(5)已知在25℃、101KPa时:2Cu(s)+W(s)=Cu2W(s)△H=-79.5KJ/mol
W(s)+Y2(g)=WY2(g)△H=-296.6KJ/mol
根据上述反应,请写出Cu2W与Y2反应生成Cu与WY2的热化学方程式Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.1KJ/mol.
1.下列有关化学用语表示正确的是( )
| A. | Na2O2的电子式为 | B. | NH4Br的电子式: | ||
| C. | 氢氧根离子的电子式: | D. | HClO的电子式: |
 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题: