题目内容
【题目】资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是
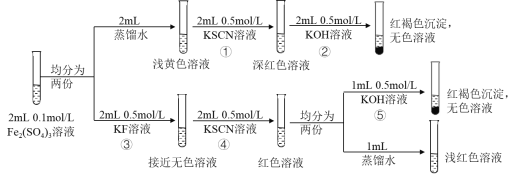
A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
【答案】C
【解析】
A.反应③由黄色转成无色,存在平衡Fe3++3F-![]() FeF3,FeF3是弱电解质,故A正确;
FeF3,FeF3是弱电解质,故A正确;
B.④中由无色转变为红色,发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-,故B正确;
C.相同条件下,结合Fe3+的能力:OH->SCN->F-,故C错误;
D.对于平衡FeF3+3SCN-Fe(SCN)3+3F-,向Fe(SCN)3溶液中加入NaF固体,提高氟离子浓度,平衡逆向移动,溶液颜色会变浅,故D正确;
故选C。

练习册系列答案
相关题目