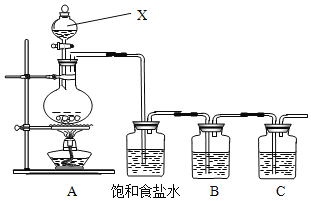
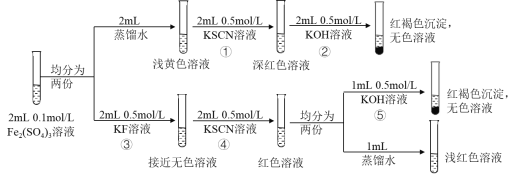
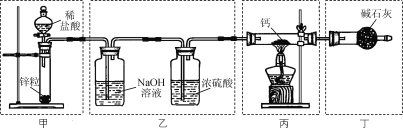
题目内容
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_______。
Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。
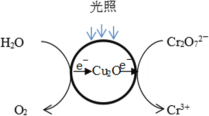
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:_______。
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______,依据是_______。

(3)溶液的pH对Cr2O72-降解率的影响如图所示。
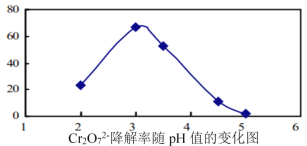
已知:Cu2O![]() Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
①pH分别为2、3、4时,Cr2O72-的降解率最好的是___________,其原因是___________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是___________。
【答案】2Cu-2e-+2OH-=Cu2O+H2O 2Cu2++SO32-+2H2O=Cu2O+4H++SO42-,反应过程中溶液的酸性不断地增强,为控制pH=5的反应条件,所以需要加入烧碱 Cr2O72—+14H++6e-=2Cr3++7H2O Cu2O作光催化剂 若发生氧化还原反应,则存在比例:3Cu2O—Cr2O72-,计算得:1×10-3×3×70%=2.1×10-3>2×10-4mol/L;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在 3 pH<2.5时Cu2O会歧化(转化)为Cu和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3 pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行
【解析】
Ⅰ.(1)反应只消耗了铜和水,说明铜在阳极放电,阳极电极反应式是2Cu-2e-+2OH-=Cu2O+H2O。故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(2)利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是:2Cu2++SO32-+2H2O=Cu2O+4H++SO42-,反应过程中溶液的酸性不断地增强,为控制pH=5的反应条件,所以需要加入烧碱。故答案为:2Cu2++SO32-+2H2O=Cu2O+4H++SO42-,反应过程中溶液的酸性不断地增强,为控制pH=5的反应条件,所以需要加入烧碱;
Ⅱ.(1)负极是水中-2价的氧失电子,而正极Cr2O72-转化Cr3+,电极反应为:Cr2O72-+14H++6e-=2Cr3++7H2O;故答案为:Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)若发生氧化还原反应,则存在比例:3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol·L-1;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在,故答案为:Cu2O作光催化剂;3Cu2O-Cr2O72-,计算9.60×10-4×3×69.5%=2.00×10-3>1.74×10-4mol·L-1;实验可以看到只有氧化亚铜和只有光照时,Cr2O72-的转化率很低,说明反应条件是光照条件下和Cu2O同时存在;
(3)①由图可知:pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,故答案为:pH=3;pH<2.5时Cu2O会歧化(转化)为Cu 和Cu2+,所以不选pH=2;酸性越大,Cr2O72-被还原率越大,pH=3酸性强于pH=4的溶液,所以选择pH=3;
②pH=5时,会产生Cr(OH)3沉淀覆盖在催化剂Cu2O表面,故答案为:pH=5时,会产生Cr(OH)3沉淀,沉淀覆盖在催化剂Cu2O表面,影响反应继续进行。

【题目】在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。
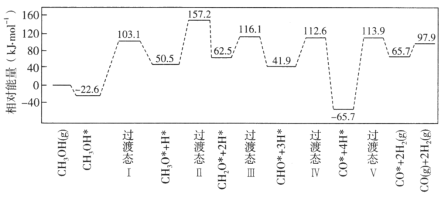
(1)![]() 的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
(2)在一定温度下,CO和H2混合气体发生反应:![]() ,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,![]() 将___________(填“增大”、“减小”或“不变”);若升高温度,
将___________(填“增大”、“减小”或“不变”);若升高温度,![]() 将____________(填“增大”、“减小”或“不变”)。
将____________(填“增大”、“减小”或“不变”)。
(3)353K时,在刚性容器中充入CH3OH(g),发生反应:![]() 。体系的总压强p随时间t的变化如表所示:
。体系的总压强p随时间t的变化如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
①若升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)___________121.2kPa(填“大于”、“等于”或“小于”),原因是________________________。
②353K时,该反应的平衡常数KP=__________(kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。