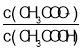��Ŀ����
����Ŀ��������ʵ���й㷺���ü�ȩ���ⶨ����ʳ��ˮ��Ʒ�е�NH4+���������õķ�Ӧԭ��Ϊ��4NH4++6HCHO��(CH2)6N4H+��һԪ�ᣩ+3H++6H2O��ʵ�鲽�����£�
�ټ�ȩ�г����������ᣬӦ�ȳ�ȥ��ȡ��ȩamL����ƿ������1~2��ָʾ������Ũ��Ϊbmol/L��NaOH��Һ�ζ����ζ��ܵij�ʼ����ΪV1mL������ƿ����Һ����ɫʱ���ζ��ܵĶ���ΪV2mL��
������ƿ���뱥��ʳ��ˮ����cmL������1���ӡ�
���������ζ�����ʣ���NaOH��Һ�����ζ���ƿ����Һ������Һ����ɫʱ���ζ��ܵĶ���ΪV3mL��
����˵������ȷ����
A.������е�ָʾ������ѡ�÷�̪��Һ
B.������о��õ�Ŀ����Ϊ��ʹNH4+��HCHO��ȫ��Ӧ
C.������������ûᵼ�²ⶨ���ƫ��
D.����ʳ��ˮ�е�c(NH4+)=![]() mol/L
mol/L
���𰸡�C
��������
A. ��ͼӦ���ɼ����ƣ���Һ�ʼ��ԣ�������е�ָʾ������ѡ�÷�̪��Һ����A��ȷ��
B. ͨ���ӳ���Ӧʱ�䣬ʹ��Ӧ���еø���֣�������о��õ�Ŀ����Ϊ��ʹNH4+��HCHO��ȫ��Ӧ����B��ȷ��
C. ������������ã�4NH4��+6HCHO�T��CH2��6N4H����һԪ�ᣩ+3H��+6H2O����Ӧ����ȫ�����ɵ����٣��ᵼ�²ⶨ���ƫ�ͣ���C����
D. ��ȥ����������������Һ����ΪV2 mL�����뱥��ʳ��ˮ����c mL���ټ�1��2�η�̪����������NaOH��Һ�ζ�����ɫ���ζ��ܵĶ���V3 mL����ʱ4NH4��+6HCHO�T��CH2��6N4H����һԪ�ᣩ+3H��+6H2O�������������Ʒ�Ӧ��4NH4��+������CH2��6N4H����һԪ�ᣩ+3H������4OH���������������ʵ����͵�Ԫ�����ʵ�����ͬ�����Ա���ʳ��ˮ�е�c(NH4+)=![]() =
=![]() mol��L��1����D��ȷ��
mol��L��1����D��ȷ��
��ѡC��

 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�