题目内容
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
【答案】NaHSO4= Na++H++SO![]() (NH4)2CO3=2NH
(NH4)2CO3=2NH![]() +CO
+CO![]() NaHCO3= Na++HCO
NaHCO3= Na++HCO![]() ①④⑨ ③⑤⑦⑧ ②⑥⑩
①④⑨ ③⑤⑦⑧ ②⑥⑩
【解析】
电解质是指在水溶液或熔融条件下能导电的化合物;非电解质是指在水溶液和熔融条件下都不能导电的化合物。
(1) 硫酸为强酸,NaHSO4电离方程式为:NaHSO4= Na++H++SO![]() ;
;
(NH4)2CO3为盐,电离方程式为:(NH4)2CO3=2NH![]() +CO
+CO![]() ;
;
碳酸为弱酸, NaHCO3电离方程式为:NaHCO3= Na++HCO![]() ;
;
(2)①NaCl溶液,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;②干冰,无自由移动的离子或电子,不能导电,是非电解质;③ 液态HCl,无自由移动的离子或电子,不能导电,在水溶液中能导电,是电解质; ④铜有自由移动电子,能导电,属于单质,既不是电解质也不是非电解质;⑤BaSO4固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑥ 蔗糖,无自由移动的离子或电子,不能导电,是非电解质;⑦Na2O,有离子,但是离子不能自由移动,不能导电,是电解质;⑧NaOH固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑨盐酸存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;⑩NH3 ,无自由移动的离子或电子,不能导电,是非电解质;
其中能够导电的是①④⑨;属于电解质的是③⑤⑦⑧;属于非电解质的是②⑥⑩。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置___,基态E2+价电子的排布图为___,B元素能量最高的电子其轨道呈__形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为__。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为___,B、C、D简单离子的半径由大到小的顺序为___。
(4)写出C的核外有18个电子的氢化物的电子式___。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO=E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___。
(6)已知沸点:B2H4>A2H6,主要原因为________。
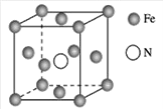
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___