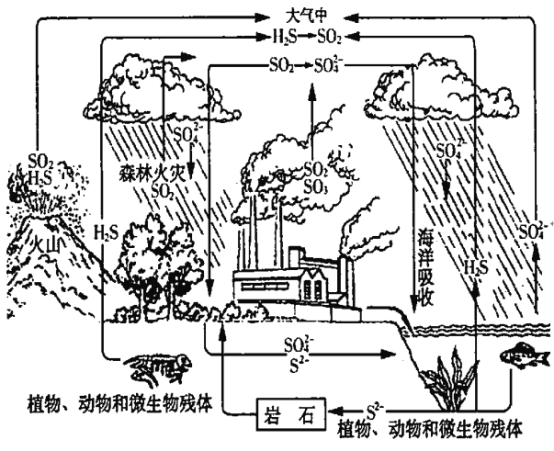
题目内容
【题目】已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示
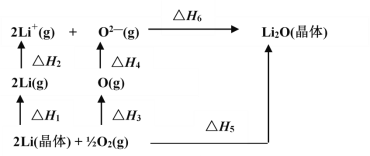
下列说法正确的是
A. △H1< 0,△H2>0B. -△H5 +△H1 +△H1 +△H3+△H4 +△H6 =0
C. △H3<0,△H4 < 0D. △H1+ △H2+△H3 +△H4 =△H5+△H6
【答案】B
【解析】
A.Li晶体转化为Li(g)是吸热过程,Li(g)→Li+(g)是失电子过程吸热,即△H1> 0、△H2>0,故A错误;
B.由盖斯定律可知,△H1 +△H1 +△H3+△H4 +△H6 =△H5 ,即-△H5 +△H1 +△H1 +△H3+△H4 +△H6 =0,故B正确;
C.![]() O2(g)到O(g)是键断裂过程吸热,O(g)→O2-(g)是得电子过程放热,即△H3>0、△H4 < 0,故C错误;
O2(g)到O(g)是键断裂过程吸热,O(g)→O2-(g)是得电子过程放热,即△H3>0、△H4 < 0,故C错误;
D.由盖斯定律可知,△H1 +△H1 +△H3+△H4 +△H6 =△H5 ,故D错误;
故答案为B。

练习册系列答案
相关题目