题目内容
1.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,2.24L CCl4所含的原子数为0.5 NA | |
| B. | 0.5 mol O2含氧原子数为0.5NA | |
| C. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
分析 A、标况下四氯化碳为液态;
B、氧气为双原子分子;
C、求出镁的物质的量,然后根据镁失电子后变为+2价来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、标况下四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量和原子个数,故A错误;
B、氧气为双原子分子,故0.5mol氧气中含1mol氧原子即NA个,故B错误;
C、2.4g镁的物质的量为0.1mol,而镁失电子后变为+2价,故0.1mol镁失去0.2mol电子即0.2NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列有关化学用语表示正确的是( )
| A. | HClO的结构式:H-O-Cl | |
| B. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| C. | CH2F2的电子式: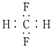 | |
| D. | Cl-的结构示意图: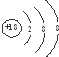 |
12.关于强、弱电解质的叙述不正确的是( )
| A. | 强电解质在溶液中完全电离,其水溶液中不存在分子 | |
| B. | 同一弱电解质溶液,温度不同时,导电能力不同 | |
| C. | 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强 | |
| D. | 强电解质在液态时不一定会导电,但在固态时一定不导电 |
9.欲配制100mL 1.0mol/L Na2CO3溶液,正确的方法是( )
①将10.6g Na2CO3溶于100mL水中
②将28.6g Na2CO3•10H2O溶于少量水中,再用水稀释至100mL
③将20ml 5.0mol/L Na2CO3溶液用水稀释至100mL.
①将10.6g Na2CO3溶于100mL水中
②将28.6g Na2CO3•10H2O溶于少量水中,再用水稀释至100mL
③将20ml 5.0mol/L Na2CO3溶液用水稀释至100mL.
| A. | 只有② | B. | ①②③ | C. | ①② | D. | ②③ |
16.标准状况下,将一个充满Cl2的试管倒置于盛有水的水槽中,经过足够长时间的光照后,则试管中主要溶质(设生成物全部留在试管中)的物质的量浓度为( )
| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{11.2}$mol/L | C. | $\frac{1}{5.6}$mol/L | D. | $\frac{1}{33.6}$mol/L |
13.某固体纯净物X受热分解:X $\frac{\underline{\;\;△\;\;}}{\;}$A↑+B↑+2CuO,气体产物对氢气的相对密度为15.5,则X的相对分子质量为( )
| A. | 31 | B. | 62 | C. | 222 | D. | 142 |
11.二氧化硫的催化氧化是放热反应.下列关于接触法制硫酸的叙述中正确的是( )
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 |

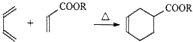
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
 、
、 .
. .
.