题目内容
13.某固体纯净物X受热分解:X $\frac{\underline{\;\;△\;\;}}{\;}$A↑+B↑+2CuO,气体产物对氢气的相对密度为15.5,则X的相对分子质量为( )| A. | 31 | B. | 62 | C. | 222 | D. | 142 |
分析 相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度是15.5,则混合气体的平均摩尔质量为31g/mol,根据质量守恒再结合M=$\frac{m}{M}$计算A的摩尔质量,摩尔质量在数值上等于其相对分子质量.
解答 解:相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为15.5,则混合气体的平均摩尔质量为31g/mol,所以A和B的质量是31g/mol×2mol=62g,生成物的质量是62g+2mol×80g/mol=222g,所以X的质量是222g,所以X得摩尔质量是222g/mol,相对分子质量是222.
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下不同气体密度与其相对分子质量的关系是解本题关键,再结合基本公式分析解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.高温、催化剂条件下,某反应达到平衡,平衡常数K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的焓变为负值 | |
| B. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g)的平衡常数K1=K2 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
4.科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与溶液中的葡萄糖发生反应生成纳米金单质颖粒(直径为20-60nm).下列有关说法错误的是( )
| A. | 氯金酸钠中金元素的化合价为+3 | |
| B. | 葡萄糖具有还原性 | |
| C. | 检测时,NaAuCl4发生氧化反应 | |
| D. | 纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |
1.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24L CCl4所含的原子数为0.5 NA | |
| B. | 0.5 mol O2含氧原子数为0.5NA | |
| C. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
8.2015年8月12日天津港危险品仓库发生的爆炸事故,再次警示人们在注重提高科技化工发展水平的同时,不可忽视化学试剂存放的基本问题.下列在实验室中关于试剂存放叙述正确的是( )

| A. | 白磷不易挥发,不需要密闭存放 | |
| B. | 氢氧化钠溶液应保存在带玻璃塞的细口试剂瓶中 | |
| C. | 氰化物的包装标签上应贴上如图所示的标志 | |
| D. | 用容量瓶配制好溶液进行贮存时,需在容量瓶上贴上浓度标签 |
5.下列说法正确的是( )
| A. | 固体氯化钠不导电,所以氯化钠是非电解质 | |
| B. | 氯化氢水溶液能导电,所以氯化氢是电解质 | |
| C. | 铜丝能导电,所以铜是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
2.在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-六种离子中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
| A. | K+、OH-、CO32 | B. | CO32-、OH-、Cl- | C. | K+、H+、Cl- | D. | Cu2+、H+、Cl- |
3.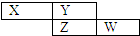 X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
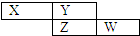 X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )| A. | 阴离子的半径从大到小排列顺序为:X>Y>Z>W | |
| B. | X元素的氢化物分子间可以形成氢键 | |
| C. | Y的两种同素异形体在常温下可以相互转化 | |
| D. | 最高价氧化物对应的水化物的酸性:W>Z |