题目内容
9.欲配制100mL 1.0mol/L Na2CO3溶液,正确的方法是( )①将10.6g Na2CO3溶于100mL水中
②将28.6g Na2CO3•10H2O溶于少量水中,再用水稀释至100mL
③将20ml 5.0mol/L Na2CO3溶液用水稀释至100mL.
| A. | 只有② | B. | ①②③ | C. | ①② | D. | ②③ |
分析 配制100mL 1.0mol/L Na2CO3溶液,所需的碳酸钠的物质的量n=CV=1mol/L×0.1L=0.1mol,所需碳酸钠的质量m=nM=0.1mol×106g/mol=10.6g;
而1mol Na2CO3•10H2O能提供1molNa2CO3,还可以用Na2CO3•10H2O来配制碳酸钠溶液,所需的Na2CO3•10H2O的质量m=nM=0.1mol×286g/mol=28.6g.
①溶液体积≠溶剂体积;
②所需的Na2CO3•10H2O的质量28.6g;
③根据溶液稀释定律C浓V浓=C稀V稀来计算.
解答 解:配制100mL 1.0mol/L Na2CO3溶液,所需的碳酸钠的物质的量n=CV=1mol/L×0.1L=0.1mol,所需碳酸钠的质量m=nM=0.1mol×106g/mol=10.6g;
而1mol Na2CO3•10H2O能提供1molNa2CO3,还可以用Na2CO3•10H2O来配制碳酸钠溶液,所需的Na2CO3•10H2O的质量m=nM=0.1mol×286g/mol=28.6g.
①将10.6g Na2CO3溶于100mL水中,所得溶液的体积大于100mL,故①错误;
②所需的Na2CO3•10H2O的质量为28.6g,故将28.6g Na2CO3•10H2O溶于少量水中,再用水稀释至100mL,故所得溶液的浓度为1mol/L,故②正确;
③设将20ml 5.0mol/L Na2CO3溶液用水稀释至100mL时溶液的浓度为xmol/L,根据溶液稀释定律C浓V浓=C稀V稀可知:20ml×5.0mol/L=xmol/L×100mL,解得x=1.0mol/L,故③正确.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算,属于基础型题目,难度不大.

 综合自测系列答案
综合自测系列答案| A. | K+、Na+、MnO${\;}_{4}^{-}$、Cl- | B. | K+、Ag+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | D. | Na+、Cu2+、NO${\;}_{3}^{-}$、Cl- |
| A. | 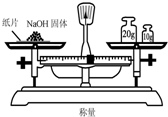 称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. | 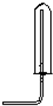 用排气法收集氯气 用排气法收集氯气 | |
| D. | 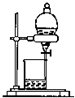 分离互不相溶的两种液体 分离互不相溶的两种液体 |
| A. | 氯金酸钠中金元素的化合价为+3 | |
| B. | 葡萄糖具有还原性 | |
| C. | 检测时,NaAuCl4发生氧化反应 | |
| D. | 纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |
| A. | 标准状况下,含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 常温常压下,64g SO2含有的原子数为3NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
| A. | 标准状况下,2.24L CCl4所含的原子数为0.5 NA | |
| B. | 0.5 mol O2含氧原子数为0.5NA | |
| C. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
