题目内容
6.将9.6g铜粉加入55mL浓硝酸中,随着铜粉的不断溶解,产生的气体的颜色不断变浅,待铜和硝酸恰好完全反应后,共收集到气体5.6L,求原硝酸的物质的量浓度.分析 n(NOx)=$\frac{5.6L}{22.4L/mol}$=0.25mol,n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,根据N、Cu原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2n(Cu)+n(NOx)=0.15mol×2+0.25mol=0.55mol,根据c(HNO3)=$\frac{n}{V}$计算硝酸浓度.
解答 解:n(NOx)=$\frac{5.6L}{22.4L/mol}$=0.25mol,n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,根据N、Cu原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2n(Cu)+n(NOx)=0.15mol×2+0.25mol=0.55mol,c(HNO3)=$\frac{n}{V}$=$\frac{0.55mol}{0.055L}$=10mol/L,
答:原硝酸的物质的量浓度是10mol/L.
点评 本题考查氧化还原反应计算,为高频考点,明确各个物理量关系结合转移电子守恒是解本题关键,题目难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 标准状况下,1molH2O的体积约为22.4L | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2 NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
17.如图所示,实验操作能达到相应的实验目的是( )
| A. | 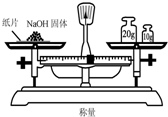 称量氢氧化钠固体的质量 称量氢氧化钠固体的质量 | |
| B. |  分离沸点相差较大的互溶液体混合物 分离沸点相差较大的互溶液体混合物 | |
| C. | 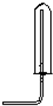 用排气法收集氯气 用排气法收集氯气 | |
| D. | 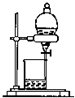 分离互不相溶的两种液体 分离互不相溶的两种液体 |
14.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 常温常压下,64g SO2含有的原子数为3NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
1.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,2.24L CCl4所含的原子数为0.5 NA | |
| B. | 0.5 mol O2含氧原子数为0.5NA | |
| C. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 氧气和臭氧的混合物16 g中约含有NA个氧原子 |
11.下列关于蒸发操作的说法正确的是( )
| A. | 蒸发时,用酒精灯直接将水蒸干以获得晶体 | |
| B. | 实验完毕,用坩埚钳取下蒸发皿于实验桌上,不能用手触碰 | |
| C. | 可以加入沸石或碎瓷片代替玻璃棒搅拌 | |
| D. | 蒸发过程中应用玻璃棒不断搅拌以防止液滴飞溅 |
15.若溶液中由水电离产生的C(OH-)=1.0×10-13 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Na+、Fe2+、NO3-、Cl- | B. | Na+、K+、NO3-、Cl- | ||
| C. | Na+、K+、Al(OH)4-、Cl- | D. | NH4+、K+、SO42-、HCO3- |
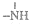 ,
,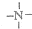 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.