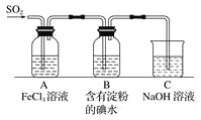
题目内容
【题目】用98%的浓硫酸(ρ=1.84 g·mL-1)配制1∶5的稀硫酸(ρ=1.19 g·mL-1)。
(1)浓硫酸的物质的量浓度是________。
(2)稀硫酸的物质的量浓度是________。
(3)稀硫酸的质量分数是____________。
【答案】18.4 mol·L-1 3.2 mol·L-1 26.4%
【解析】
根据公式c=![]() 和c=
和c=![]() 进行计算。
进行计算。
(1)密度为ρ=1.84 g·mL-1质量分数为98%的浓硫酸的浓度为:c=![]() =
=![]() 18.4 mol·L-1,答案:18.4 mol·L-1;
18.4 mol·L-1,答案:18.4 mol·L-1;
(2)设浓硫酸的体积为1 L,则水的体积为5 L;1 L浓硫酸中n(H2SO4)=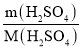
=![]() =18.4 mol,混合后溶液的体积:V=
=18.4 mol,混合后溶液的体积:V=![]() -3L/mL=5.75 L,c(H2SO4)=
-3L/mL=5.75 L,c(H2SO4)= =
=![]() =3.2 mol·L-1;答案:3.2 mol·L-1;
=3.2 mol·L-1;答案:3.2 mol·L-1;
(3)根据公式可得:ω(H2SO4)=![]() ×100%=26.4%。答案:26.4%。
×100%=26.4%。答案:26.4%。

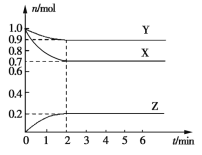
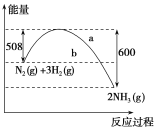
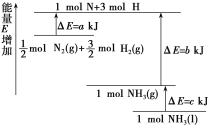
【题目】工业上通常采用N2(g)和H2(g)催化成NH3(g):N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣92.4 kJmol﹣1。
2NH3(g) ΔH=﹣92.4 kJmol﹣1。
(1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,判断平衡移动的方向是______(填“正向移动”“逆向移动”或“不移动”)。
(2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为_____;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3起始时浓度的范围为_____。
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容,测得反应达到平衡时的有关数据如表:
容器 反应物投入量 | 甲 | 乙 | 丙 | |
1molN2、3molH2 | 2molNH3 | 4molNH3 | ||
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q1 | Q1 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则Q1+Q2=___kJ;a1+a2___l(填“<”“>”或“=”,下同),2p2___p3。