题目内容
【题目】(1)如图是298K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为____。
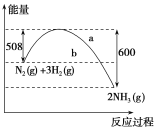
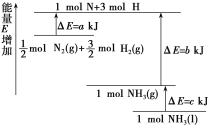
(2)化学反应N2+3H2![]() 2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
2NH3的能量变化如图所示(假设该反应反应完全),试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:____。
【答案】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1 N2(g)+3H2(g)
2NH3(g) ΔH=-92 kJ·mol-1 N2(g)+3H2(g)![]() 2NH3(l) ΔH=-2(b+c-a) kJ·mol-1
2NH3(l) ΔH=-2(b+c-a) kJ·mol-1
【解析】
(1)该反应放出的能量为600-508=92kJ,则反映的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1;
2NH3(g) ΔH=-92 kJ·mol-1;
(2)根据“反应热=断键吸收的能量-成键放出的能量”和已知的化学反应能量图可得,
①![]() molN2(g)+
molN2(g)+![]() molH2(g)1molNH3(g),ΔH=(a-b) kJ/mol,
molH2(g)1molNH3(g),ΔH=(a-b) kJ/mol,
② NH3(g)2NH3(l) △H=-ckJ/mol;
由盖斯定律:①×2+②×2可得N2(g)+3H2(g)2NH3(l)△H=2×(a-b)-2c=2(a-b-c)kJ/mol;
由反应能量图可知,该反应的生成物总能量小于反应物的总能量,所以反应放热,即△H为“-”,因此可得反应的热化学方程式是:N2(g)+3H2(g)2NH3(l) △H=-2(c+b-a)kJ/mol。

【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
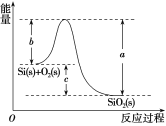
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1