题目内容
【题目】工业上通常采用N2(g)和H2(g)催化成NH3(g):N2(g)+3H2(g)![]() 2NH3(g) ΔH=﹣92.4 kJmol﹣1。
2NH3(g) ΔH=﹣92.4 kJmol﹣1。
(1)在一定温度下,若将10amol N2和30amol H2放入2 L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,判断平衡移动的方向是______(填“正向移动”“逆向移动”或“不移动”)。
(2)若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3达到平衡时浓度的范围为_____;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,则NH3起始时浓度的范围为_____。
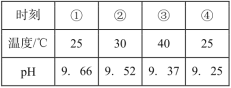
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容,测得反应达到平衡时的有关数据如表:
容器 反应物投入量 | 甲 | 乙 | 丙 | |
1molN2、3molH2 | 2molNH3 | 4molNH3 | ||
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q1 | Q1 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | p2 | p3 | |
则Q1+Q2=___kJ;a1+a2___l(填“<”“>”或“=”,下同),2p2___p3。
【答案】![]() 正向移动 0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1 0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1 92.4 = >
正向移动 0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1 0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1 92.4 = >
【解析】
(1)利用三段法计算出平衡时各物质的浓度,再计算平衡常数,然后利用Q与K的关系来分析平衡的移动;
(2)可假设反应正向进行或逆向进行达到平衡,并结合可逆反应的限度来判断即可;
(3)甲容器反应物投入1 mol N2、3 mol H2,乙容器反应物投入量2 mol NH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1 mol N2、3 mol H2,丙容器反应物投入量4 mol NH3,采用极限转化法转化为反应物为2 mol N2、6 mol H2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动。
(1)由将10amol N2和30amol H2放入2L的密闭容器中,充分反应后测得N2的转化率为60%,则转化的N2的物质的量为10a mol![]() 60%=6a mol,
60%=6a mol,
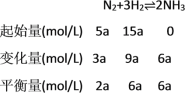 ,则平衡常数K=
,则平衡常数K=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
若此时再向该容器中投入10amol N2、20amol H2和20amol NH3,三者的浓度分别为:7a mol/L、16a mol/L、16a mol/L;则浓度商Qc=![]() =
=![]() <K,此时平衡正向进行;
<K,此时平衡正向进行;
故答案为:![]() ;正向移动;
;正向移动;
(2) 若反应起始时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,假设反应正向进行,则N2的最大转化浓度为0.1 mol·L﹣1,则NH3的变化浓度为0.2 mol·L﹣1,即平衡时NH3的浓度小于0.3 mol·L﹣1,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0 mol·L﹣1,故NH3达到平衡时浓度的范围为0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1;若平衡时N2、H2、NH3的浓度分别为0.1 mol·L﹣1、0.3 mol·L﹣1、0.1 mol·L﹣1,如果反应是从反应物方向开始的,NH3的起始浓度为0 mol·L﹣1,如果反应是生成物方向进行的,生成0.1 mol·L﹣1N2时消耗NH3的浓度分别为0.05 mol·L﹣1,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0 mol·L﹣1c(NH3)0.3 mol·L﹣1;
故答案为:0 mol·L﹣1<c(NH3)<0.3 mol·L﹣1;0 mol·L﹣1≤c(NH3)≤0.3 mol·L﹣1;
(3)甲投入1 mol N2、3 mol H2,乙中投入2 mol NH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4 kJ,Q1+Q2=92.4;转化率α1+α2=1;丙容器反应物投入量4 mol NH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍,由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3;
故答案为:92.4;=

 53随堂测系列答案
53随堂测系列答案