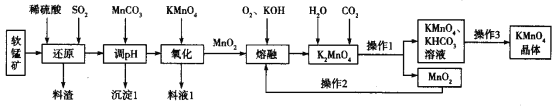
题目内容
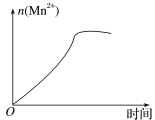
【题目】某温度时,X、Y、Z在一个容积为2L的密闭容器中反应,这三种物质的物质的量随时间的变化曲线如图所示。
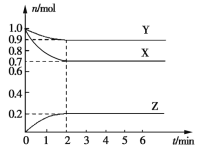
根据图中数据回答下列问题:
(1)该反应的化学方程式为____。
(2)在前2min内,气体Z的化学反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②若此时将容器的容积减小为原来的![]() ,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
(4)若上述反应在第2min后的t1~t6内反应速率与反应时间的关系如下,在每一时刻均只改变一个条件,则____。
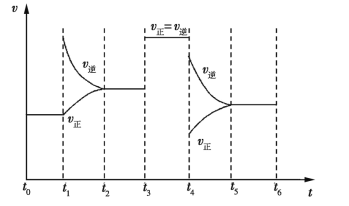
A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.在t2~t3时X的转化率最高
【答案】3X+Y![]() 2Z 0.05mol·L-1·min-1 0.9 放热 B
2Z 0.05mol·L-1·min-1 0.9 放热 B
【解析】
(1)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,写出化学方程式;
(2)根据2min内Z的物质的量变化量和容器体积,结合化学反应速率的计算公式计算;
(3)①同温同体积条件下,气体的压强之比等于物质的量之比,结合图像分析解答;
②体积缩小到原来的![]() 倍,则压强变为原来的2倍,平衡向着气体体积缩小的方向移动,根据反应方程式可知,平衡向右移动,结合温度的变化分析判断;
倍,则压强变为原来的2倍,平衡向着气体体积缩小的方向移动,根据反应方程式可知,平衡向右移动,结合温度的变化分析判断;
(4)根据图像,判断各时刻平衡的移动方向,结合影响平衡的因素分析判断。
(1)由图像可知X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比等于它们的物质的量变化之比为0.3mol∶0.1 mol∶0.2 mol =3∶1∶2,所以反应的方程式为3X+Y2Z;
(2)根据图像,前2 min内,v(Z)= =0.05molL-1min-1;
=0.05molL-1min-1;
(3)①若X、Y、Z均为气体,根据图像可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,![]() =
=![]() =
=![]() ═0.9;
═0.9;
②若X、Y、Z均为气体,反应的方程式为3X(g)+Y(g)![]() 2Z(g),将容器的容积减小为原来的
2Z(g),将容器的容积减小为原来的![]() ,平衡正向移动,容器内温度将升高,说明正反应为放热反应,故答案为:放热;
,平衡正向移动,容器内温度将升高,说明正反应为放热反应,故答案为:放热;
(4)根据图像,
A、t1时逆反应速率增大,正反应速率不变,应该为增大了生成物的浓度,平衡逆向移动,故A错误;
B、t3时反应速率加快,但平衡不移动,应为加入了催化剂,故B正确;
C、t4时反应速率均减小,平衡逆向移动,应为减小压强,故C错误;
D、t2~t3时是平衡逆向移动的结果,则X的转化率比t1低,故D错误;
故答案为:B。

 名校课堂系列答案
名校课堂系列答案【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
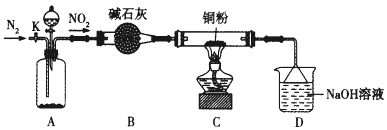
(1)装置A~C中有一处错误,改正的方法是_____________,A中发生反应的两种试剂通常是________。
(2)点燃C处酒精灯比较合适的时机是_____________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:______________。装置D的用途是____________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法______________。(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是![]() ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
稀硫酸 | 氨水 | |
Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
Cu | --- | --- |
请设计一个简单的实验证明甲同学的看法是否正确:________________。
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
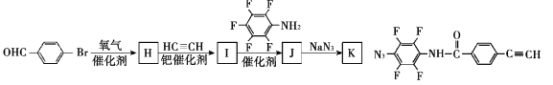
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。