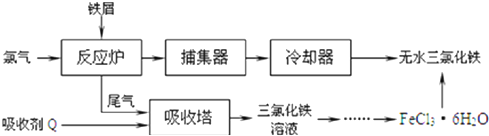
题目内容
20.现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等.请回答下列问题:(1)元素B在周期表中的位置第二周期第VA族.
(2)A2C比A2E沸点高的原因是H2O分子之间能形成氢键.
(3)写出同时含A、B、C、E四种元素的三种盐的化学式NH4HSO3、(NH4)2SO4、NH4HSO4.
(4)A2C的电子式为
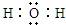 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式NH3+H+═NH4+
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将减小(填“增大”、“减小”或“不变”).
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下均为液态,化合物为水、过氧化氢,则A为H元素,C为O元素;A、D同主族,D原子序数大于氧元素,则D为Na元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为6-1=5,原子序数小于氧元素,则B为N元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,核外电子总数为18,则F为Cl元素,以此解答该题.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下均为液态,化合物为水、过氧化氢,则A为H元素,C为O元素;A、D同主族,D原子序数大于氧元素,则D为Na元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为6-1=5,原子序数小于氧元素,则B为N元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,核外电子总数为18,则F为Cl元素,
(1)B为氮元素,在周期表中的位置是第二周期第ⅤA族,故答案为:第二周期第VA族;
(2)H2O分子间有氢键,H2S分子间不能形成氢键,所以沸点比H2S高,故答案为:H2O分子之间能形成氢键;
(3)A为H元素、B为N元素、C为O元素、E为S元素,同时含A、B、C、E四种元素的盐有等NH4HSO3、(NH4)2SO4、NH4HSO4、(NH4)2SO3,
故答案为:NH4HSO3;(NH4)2SO4;NH4HSO4;
(4)A2C为H2O,电子式为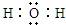 ,Na2O2形成的一种化合物与H2O发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,
,Na2O2形成的一种化合物与H2O发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为: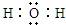 ;2Na2O2+2H2O═4Na++4OH-+O2↑;
;2Na2O2+2H2O═4Na++4OH-+O2↑;
(5)B为N元素,对应的最高价氧化物的水化物与其氢化物反应为硝酸和氨气的反应,离子方程式为NH3+H+═NH4+,故答案为:NH3+H+═NH4+;
(6)在一定条件下,氢气、氧气和NaOH的水溶液可构成电池,正极发生还原反应,氧气在正极放电生成氢氧根,正极电极反应式为O2+2H2O+4e-═4OH-,负极发生氧化反应,氢气在负极放电,碱性条件下生成水,负极电极反应为:2H2+4OH--4e-═4H2O,反应过程中生成H2O,使c(OH-)降低,pH减小,故答案为:减小.
点评 本题以元素推断为载体,考查原子结构示意图、氢键对物质性质影响、原电池等为高考常见题型,侧重学生的分析能力的考查,难度中等,推断元素是解题关键,注意理解原电池原理.

 名校课堂系列答案
名校课堂系列答案| A. | 2-氯丙烷 | B. | 氯乙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
①氢硫酸溶液在空气中置露会变浑浊
②在通常状况下,氧单质的熔沸点比硫单质低
③硫化氢在加热的条件下既可分解成氢气和硫,而水在高温时很少分解
④铜与硫反应生成硫化亚铜,与氧气反应生成氧化铜.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
| A. | 碳和硅都是ⅣA的元素,CO2和SiO2属于同种类型的晶体 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | H2O、H2S、H2Se的分子结构和组成相似,随着相对分子质量的增加,它们的熔点依次升高 | |
| D. | Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
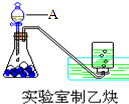 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.