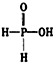题目内容
9.下列说法合理的是( )| A. | 碳和硅都是ⅣA的元素,CO2和SiO2属于同种类型的晶体 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | H2O、H2S、H2Se的分子结构和组成相似,随着相对分子质量的增加,它们的熔点依次升高 | |
| D. | Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
分析 A.根据晶体的构成微粒以及微粒间的作用力分析;
B.元素的非金属性与氢化物水溶液的酸性无关;
C.氢化物的相对分子质量越大,熔点越高,含有氢键的熔点较高;
D.根据同周期元素自左而右金属性变化规律分析.
解答 解:A.碳和硅都是ⅣA的元素,CO2晶体中分子间通过分子间作用力结合为分子晶体,SiO2中原子间通过共价键形成空间网状结构属于原子晶体,故A错误;
B.元素的非金属性与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故B错误;
C.氢化物的相对分子质量越大,熔点越高,含有氢键的熔点较高,由于水分子间存在氢键,熔点较高,则熔点由低到高的顺序为:H2S、H2Se、H2O,故D错误;
D.同周期元素自左而右金属性减弱,金属性Cs>Ba,金属性越强最高价氧化物对应水化物的碱性越强,故碱性CsOH>Ba(OH)2,故D正确;
故选D.
点评 本题考查了晶体类型的判断、元素周期表结构、元素周期律等知识,难度不大,注意对规律的理解掌握.

练习册系列答案
相关题目
20.按电子排布,可把周期表里的元素划分成5个区,区的名称来自按构造原理最后填入电子的能级符号,5个区分别为s区、d区、p区、ds区和f区.电子构型为[Xe]4f145d76s2的元素位于周期表中的哪个区( )
| A. | s区 | B. | d区 | C. | f区 | D. | ds区 |
4.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
14.草药莪术根茎中含有一种色素,它的结构简式为CH2(COCH=CH-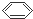 -OH)2用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
-OH)2用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
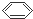 -OH)2用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
-OH)2用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3 mol 3 mol | B. | 3 mol 5 mol | C. | 6 mol 6 mol | D. | 6 mol 10 mol |
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
(1)写出下列元素的名称:B氧,E氯;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
18.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B 在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为 .
.
(1)A在周期表中的位置是第一周期ⅠA族,
(2)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
b的化学式为Na2O2和Na2C2(写一种即可);
c的电子式为
 .
. 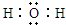 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑ 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题:
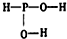
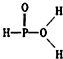
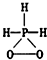
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)请回答下列问题: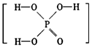 已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )
已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是( )