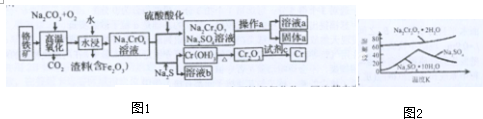
题目内容
15.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
分析 由表中数据可知,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量,而固体混合物从15.7 g→27.6 g,二氧化碳气体的体积不再变化,说明故加入27.6 g混合物时盐酸过不足,生成3.36L CO2需要固体质量为9.2g×$\frac{3.36L}{2.24L}$=13.8g<15.7g,故第2组实验中盐酸也不足.盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸浓度;加入9.2g混合物时,盐酸有剩余,混合物完全反应,根据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数.
解答 解:由表中数据可知,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量,而固体混合物从15.7 g→27.6 g,二氧化碳气体的体积不再变化,说明故加入27.6 g混合物时盐酸过不足,生成3.36L CO2需要固体质量为9.2g×$\frac{3.36L}{2.24L}$=13.8g<15.7g,故第2组实验中盐酸也不足,
A.盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑,可知n(HCl)=n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,故盐酸的浓度为:$\frac{0.15mol}{0.05L}$=3mol/L,故A错误;
B.第一组中盐酸不足,固体混合物完全反应,设NaHCO3和KHCO3的物质的量分别为x、y,则84x+100y=9.2g,x+y=$\frac{2.24}{22.4}$=0.1,解得:x=y=0.05mol,则碳酸氢钠的质量分数为:$\frac{84g/mol×0.05mol}{9.2g}$=0.457,故B正确;
C.根据B的计算可知,加入固体混合物中NaHCO3和KHCO3的物质的量之比为1:1,其质量之比为84:100,故C错误;
D.由上述分析可知,向50mL盐酸中加入15.7g混合物时,盐酸不足,固体混合物过量,故D错误;
故选B.
点评 本题考查混合物的有关计算,题目难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.

 阅读快车系列答案
阅读快车系列答案| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 全部由非金属组成的化合物可能是离子化合物 |
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
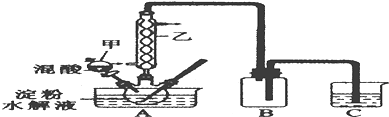
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;C、N、O、F的第一电离能由大到小的顺序是F>N>O>C.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
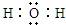 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑