题目内容
10.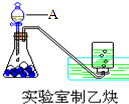 (1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(1)实验室制取乙炔的实验装置图(如图)中,A仪器的名称为分液漏斗;所盛的试剂为饱和食盐水.发生反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑.(2)将反应产生的乙炔通入酸性高锰酸钾溶液中,观察到的现象是:酸性高锰酸钾溶液紫色褪去;将反应产生的乙炔通入溴的四氯化碳溶液中,反应的化学方程式为:CH≡CH+Br2→CHBr═CHBr.(产物为1,2-二溴乙烯)
(3)生成的乙炔中可能含有的杂质气体是H2S、AsH3、PH3等,除去的方法是将混合气体通过CuSO4溶液(或NaOH溶液)洗气.
分析 (1)依据实验室常见仪器回答;电石与水反应速率较快,一般用饱和食盐水代替水制取,电石与水反应生成乙炔和氢氧化钙,据此书写化学反应方程式;
(2)乙炔中含有碳碳三键,能与高锰酸钾溶液反应使其褪色;1mol乙炔与1mol溴发生加成反应生成1,2-二溴乙烷;
(3)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,据此解答即可.
解答 解:(1)仪器A为分液漏斗,锥形瓶中盛放电石,由于电石与水反应太快,故利用饱和食盐水代替水,反应方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:分液漏斗;饱和食盐水;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔与酸性高锰酸钾溶液反应,高锰酸钾溶液紫色褪去,1mol乙炔与1mol溴反应生成1,2-二溴乙烷,反应方程式为:CH≡CH+Br2→CHBr═CHBr,
故答案为:CH≡CH+Br2→CHBr═CHBr;
(3)硫化氢和硫酸铜反应生成沉淀,磷化氢易溶于水,可用硫酸铜除去,故答案为:将混合气体通过CuSO4溶液(或NaOH溶液)洗气.
点评 本题主要考查的是乙炔的制取以及物质的分离与提纯,涉及化学反应方程式的书写,难度不大.

练习册系列答案
相关题目
20.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同,将 1.0L这种混合气体在氧气中充分燃烧,生成2.0LCO2和2.4L水蒸气(相同条件下测定).则混合物中烷烃和烯烃的体积比为( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
1.下列各项不属于官能团的是( )
| A. | NO${\;}_{3}^{-}$ | B. | -Cl | C. |  | D. | -NO2 |
15.下列物质不可以导电的是( )
| A. | 甲苯 | B. | 金属Cu | C. | NaCl溶液 | D. | HCl溶液 |
2.下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
| A. | [Ne]3s1[Ne]3s2 | B. | [Ar]4s1[Ne]3s23p4 | ||
| C. | [Ne]3s2[Ar]4s2 | D. | [He]2s22p4[Ne]3s23p5 |
19.在一定条件下RO3-与R-发生如下反应:RO3-+5R-+6H+=3R2+3H2O,则下列关于R元素的说法中正确的是( )
| A. | R位于元素周期表中的第VA族 | B. | R位于元素周期表中的第 VIIA族 | ||
| C. | RO3-中的R元素只能被还原 | D. | R2在常温常压下一定是气体 |
 .
. ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑